
¿Por qué limpia el jabón?

Fotografía tomada de la
Wikipedia
Hay ocasiones en las que lo más habitual es también lo más desconocido. ¿Se han preguntado ustedes alguna vez por qué algo tan corriente como el jabón es capaz de quitar las manchas? Bueno, el jabón, el champú, el gel de baño, el detergente, el lavavajillas, el limpiacristales... productos que, aunque su composición varía, operan de la misma manera, por lo que para la explicación voy a ceñirme al más humilde de todos ellos y también al más antiguo, puesto que ya se conocía en el tercer milenio antes de Cristo: el jabón, siendo el resto variantes mejoradas que comparten con él sus propiedades físicas y químicas.
Asimismo, a lo largo del tiempo el propio jabón ha experimentado mejoras sin alterar desde un punto de vista químico su funcionamiento como agente limpiador, que es lo que voy a explicar aunque previamente será necesaria una pequeña lección de química.
Como es sabido, los átomos de los distintos elementos presentes en la naturaleza se agrupan entre sí de varias maneras, siendo una de las principales en forma de moléculas. Las moléculas son asociaciones de átomos, generalmente en un número pequeño aunque hay excepciones, que se caracterizan por estar formadas por un número determinado de átomos de uno o varios elementos químicos, siempre el mismo de todos ellos. Cuando la molécula crece en complejidad es preciso considerar también la forma en la que estos átomos se colocan en ella, lo que da pie a lo que los químicos llamamos isomería, aunque en las más sencillas, al existir tan sólo una manera posible de distribución según ciertas reglas que no es preciso comentar aquí, esto no suele ser necesario. Lo importante es que cada molécula constituye un compuesto químico, y al variar alguno de los parámetros que la definen obtendremos un compuesto distinto.
Así, empezando por lo más sencillo, tenemos varios ejemplos: la molécula de oxígeno está constituida por dos átomos de oxígeno, la de hidrógeno por dos átomos de hidrógeno, la de agua por dos átomos de hidrógeno y uno de oxígeno, la de dióxido de carbono por dos átomos de oxígeno y uno de carbono, la de metano por un átomo de carbono y cuatro de hidrógeno, la de amoníaco por un átomo de nitrógeno y tres de hidrógeno, la de ácido sulfúrico por un átomo de azufre, cuatro de oxígeno y dos de hidrógeno...
Puesto que en la química orgánica las moléculas empiezan a ser más complejas, me limitaré a hablar de ellas de la manera más sencilla posible, aunque la mecánica es esencialmente la misma.
Ahora tenemos que conocer una propiedad básica de las moléculas, su polaridad. Todos los átomos tienen una afinidad específica hacia los electrones -que, recordemos, son cargas eléctricas negativas-, que se mide según una escala llamada de electronegatividad. No voy a entrar en demasiados detalles sobre este tema, salvo para indicar que cuando dos átomos se unen entre sí mediante un enlace para formar una molécula o la parte de una molécula, si su electronegatividad es diferente se produce lo que los físicos definen como un dipolo, es decir, un imán en miniatura que, como tal, posee sus dos polos, el negativo sobre el átomo más electronegativo y el positivo sobre el menos electronegativo.
En el caso de moléculas diatómicas, con tan sólo dos átomos, el dipolo del enlace coincide con el de la propia molécula, como es el caso del cloruro de hidrógeno o ClH, formado por un átomo de cloro y otro de hidrógeno, siendo el cloro más electronegativo que el hidrógeno, por lo que es él quien soporta el polo negativo mientras el hidrógeno se convierte en el positivo. Obviamente si los dos átomos son iguales, como ocurre con la molécula de hidrógeno o la de oxígeno, la diferencia de electronegatividad es nula y por lo tanto no existe tal dipolo.
En una molécula poliatómica, es decir, con más de dos átomos iguales o diferentes, cada uno de los enlaces entre dos átomos contiguos tendrá su propia polaridad en función de la naturaleza de los átomos y también de cómo estén éstos enlazados a otros, por lo que cada enlace diatómico tendrá o no su propia polaridad o, para ser más precisos, su propio momento dipolar. La suma vectorial, teniendo en cuenta la geometría tridimensional de la molécula, de todos estos dipolos tendrá como resultante el momento dipolar molecular, pudiéndose dar tres casos distintos:
-Que no exista momento dipolar molecular porque los momentos dipolares de los enlaces son nulos.
-Que no exista momento dipolar molecular porque, aunque existen momentos dipolares en los enlaces, éstos se anulan por geometría, tal como ocurre cuando dos equipos están tirando de una soga con la misma fuerza, con lo cual la soga no se mueve pese a los esfuerzos de ambos.
-Que exista un momento dipolar molecular resultante de la suma vectorial de los momentos dipolares de los diferentes enlaces.
En los dos primeros casos, tanto da que sea uno u otro, el resultado es el mismo: la molécula es apolar o, si se prefiere, no presenta comportamiento magnético. En el tercero, por el contrario, la molécula es polar y sí posee un componente magnético.
¿Ha quedado entendido? Pues pasemos a ver varios ejemplos. El agua, uno de los compuestos más comunes, es polar puesto que los dos enlaces oxígeno-hidrógeno lo son, y dado que éstos forman un ángulo con el oxígeno en el vértice y los hidrógenos en los dos extremos, la suma vectorial de los dos momentos dipolares de los enlaces da un momento dipolar neto con el polo negativo situado sobre el oxígeno y el polo positivo en el extremo de la bisectriz del ángulo, entre los dos hidrógenos. Recordemos este dato, puesto que lo necesitaremos más adelante.
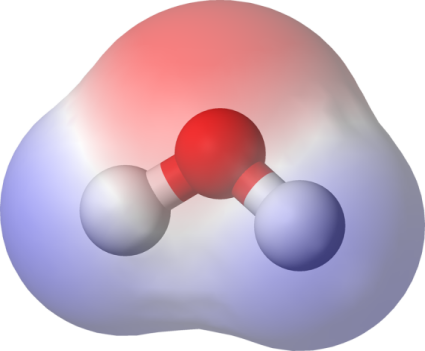
Polaridad de la molécula de agua. El
polo negativo (rojo) corresponde al
átomo de oxígeno, y el
polo positivo (azul) a los átomos de hidrógeno
Ahora voy a recordar un viejo aserto que me explicaron mis profesores de química que, aunque pueda parecer trivial, explica a la perfección la función del jabón: “semejante disuelve a semejante”. Esto, que ya conocían los antiguos alquimistas de forma experimental, puede ser explicado más científicamente diciendo que las sustancias polares se mezclan con otras sustancia polares y las apolares con las apolares, pero no entre sí.
Aunque no creo que sea necesario explicar qué es una disolución, voy a matizar tan sólo que se trata de una mezcla entre dos sustancias una de las cuales, la de mayor cantidad, suele ser líquida -el disolvente- mientras la otra -el soluto- puede presentarse en cualquiera de los tres estados. En realidad existen disoluciones en las que el disolvente no es líquido, pero mejor no liarnos demasiado quedándonos con lo fundamental.
Así, el agua puede disolver sólidos como la sal o el azúcar, líquidos como el alcohol o gases como el CO2. Si pongo como ejemplo el agua es porque se trata de uno de los disolventes más habituales -aunque no el único- y está presente por todos los lados.
Pero el agua, pese a su gran efectividad como disolvente, no disuelve todo, sino tan sólo a las sustancias que, como ella, son polares. Baste con intentar mezclar agua con aceite -que no es polar- para comprobar que no es posible hacerlo, quedando el aceite en una capa flotando sobre el agua debido a su menor densidad.
Por supuesto que a una sustancia apolar como el aceite es posible disolverla, pero para ello es necesario recurrir a un disolvente también apolar, como por ejemplo la gasolina o el benceno, para conseguirlo. Recordémoslo, “semejante disuelve a semejante”.
Y ahora entramos ya en harina. Imagínense que ustedes quieren lavar una prenda sucia y que sólo disponen de agua. Puesto que la suciedad es una mezcla compleja -su composición dependerá de por donde hayamos andado- de sustancias polares y apolares, por mucho que nos empeñemos el agua tan sólo conseguirá arrastrar a las primeras, por lo que el resultado tan sólo será satisfactorio a medias.
¿Qué podemos hacer con el resto de la suciedad que no hemos conseguido limpiar con agua? La respuesta inmediata sería utilizar un segundo disolvente apolar, como, por seguir con el mismo ejemplo, gasolina, aunque existen muchos más. ¿Conseguiríamos limpiar con ella lo que hubiera dejado el agua? Pues... en principio sí, pero seguramente no sería una buena idea por varias razones.
La primera es la económica: cualquier disolvente apolar que utilizáramos, incluyendo el más barato, sería mucho más caro que el agua, eso sin contar con su poder contaminante u otros posibles inconvenientes como que muchos de ellos son inflamables. También podría ocurrir que dañaran la ropa o la destiñeran, algo que seguramente nos haría muy mucha gracia. Y además habría que lavarla dos veces, primero con agua y luego con el disolvente, o al contrario, con el consiguiente engorro.
Cierto es que en ocasiones resulta necesario hacerlo, como ocurre cuando llevamos una prenda a la tintorería para que le quiten una mancha pertinaz que no hay manera humana de eliminar con nuestros medios caseros; es lo que se anuncia como limpieza en seco aunque en realidad no es tal, ya que aunque no se usa agua sí se utilizan otros disolventes líquidos capaces de quitar de en medio esas inoportunas manchas... pero mejor no intentarlo en casa.
En cualquier caso, ¿no sería mejor hacerlo todo de una vez? Bien, para eso se inventaron el jabón y todos sus parientes.
Reflexionemos sobre la naturaleza de la cuestión. Las manchas que no limpia el agua -me refiero obviamente al agua pura sin ningún ingrediente añadido- suelen estar constituidas por grasa o por sustancias afines, todas ellas apolares y por lo tanto insolubles en agua. La idea estaría en lavar la ropa con una mezcla de agua y un disolvente apolar, pero aparte de los inconvenientes ya aducidos nos encontramos con un nuevo problema: como ya he comentado, no se mezclan. Lo ideal sería disponer de una sustancia ambidextra que no hiciera ascos ni a lo uno ni a lo otro. ¿Existe? Pues sí, es el jabón, capaz de mezclarse tanto con el agua como con las manchas haciendo de puente entre ambas.
Y ahora discúlpenme que les dé otra pequeña lección de química empezando no por el jabón sino por las grasas y los aceites, todos los cuales tienen unas propiedades comunes.
Las grasas, de sobra conocidas por todos, tienen una composición química similar a partir de dos componentes básicos, la glicerina y los ácidos grasos. La glicerina es un alcohol pariente del alcohol común, el etílico o etanol, sólo que su molécula tiene tres átomos de carbono en lugar de los dos del etanol y tres grupos alcohol, formados por un átomo de oxígeno y otro de hidrógeno -OH, uno en cada uno de los átomos de carbono, mientras el etanol tiene tan sólo uno. Veamos sus respectivas fórmulas:
| H | ||||||
| | | ||||||
| H | — | C | — | O | — | H |
| | | ||||||
| H | — | C | — | O | — | H |
| | | ||||||
| H | — | C | — | O | — | H |
| | | ||||||
| H |
Para la glicerina, y:
| H | ||||||
| | | ||||||
| H | — | C | — | H | ||
| | | ||||||
| H | — | C | — | O | — | H |
| | | ||||||
| H |
Para el etanol.
Por su parte, los ácidos grasos son un tipo de compuestos formados por una cadena de átomos de carbono e hidrógeno terminada en un grupo ácido:
| — | C | — | O | — | H |
| ║ | |||||
| O |
Mientras el grupo ácido es común a todos ellos la cadena varía de uno a otro, lo que determina sus características propias. Estos ácidos, como su nombre indica, derivan de compuestos grasos naturales, lo que hace que sus nombres tradicionales sean bastante pintorescos: butírico, caproico, pelargónico, mirístico, palmítico, margárico, esteárico, oleico, láurico... en cuanto a sus características, seguro que habrán oído hablar de los ácidos grasos insaturados, los saturados, los omega-3, etcétera.
Las grasas y los aceites se forman por el enlace -los químicos lo llamamos esterificación- de una molécula de glicerina con tres de ácidos grasos, iguales o diferentes, uno en cada uno de los tres grupos alcohol; como existen muchos ácidos grasos y además se pueden combinar de tres en tres, la cantidad existente de grasas y aceites -la diferencia entre ambos es que las grasas son sólidas a temperatura ambiente y los aceites líquidos- es muy elevada dependiendo de su composición, que a su vez depende de su procedencia. Como es sabido la calidad de las grasas varía mucho de unas a otras, no es lo mismo el aceite de oliva que el de palma, pero como este artículo no está destinado a la nutrición pasaré por alto este tema.
Obviamente los aceites -descarto las grasas porque ni siquiera son líquidas- no resultarían muy útiles para lavar la ropa, por mucho que disolvieran las manchas rebeldes; pero si se consiguiera obtener un derivado de éstos capaz de hacerlo y que, al mismo tiempo, fuera soluble con el agua, tendríamos el problema resuelto.
La solución, como cabe suponer, está en el jabón. Las grasas no poseen polaridad, ya que aunque sus componentes por separado sí la tienen, la glicerina por los grupos alcohol - OH y los ácidos grasos por los grupos ácido - COOH, al combinarse ambos desaparecen tanto los grupos alcohol como los ácido, de forma que la molécula de grasa -el éster, en términos químicos- carece de polaridad. Pero, ¿qué pasaría si lográramos romper las moléculas de grasa convirtiéndolas en una mezcla de glicerina y ácidos grasos? Pues que tendríamos jabón o, más exactamente, algo muy parecido.
Aunque yo estoy hablando como conocedor de los mecanismos involucrados en las reacciones químicas, cabe suponer que no sólo los inventores del jabón, sino también quienes se dedicaron a fabricarlo durante milenios lo hacían de una forma totalmente empírica aprendida mediante el habitual proceso de ensayo y error... pero les funcionaba, puesto que se trata de un proceso sumamente sencillo al alcance de la tecnología de la que se disponía hace miles de años.
El truco para romper las moléculas de grasa consiste en tratarlas con una disolución concentrada de sosa o potasa o, si se prefiere, de hidróxido sódico o hidróxido potásico. Ambos son unos reactivos muy potentes de propiedades cáusticas, es decir, corrosivas al igual que los ácidos aunque su comportamiento químico es el opuesto. Pero tampoco es necesario entrar en detalles. Lo que nos interesa saber es que estos álcalis, nombre con el que se les conoce, son capaces de romper -hidrolizar para los químicos- las moléculas de grasa en sus dos componentes, glicerina y ácidos grasos.
Estas sustancias, que ya se conocían en la antigüedad, se obtenían de las cenizas que quedaban como residuo de la combustión de determinadas plantas -la sosa- o de algas -la potasa-, aunque en la actualidad se producen por síntesis química. Por su parte, la fabricación del jabón por el método tradicional tampoco resulta demasiado complicada: basta con mezclar grasa de cualquier procedencia -aceites vegetales, sebo animal- con una disolución concentrada y caliente de sosa o potasa en proporciones adecuadas agitándola durante cierto tiempo hasta que se produce el jabón, fácilmente identificable por su aspecto y textura. Posteriormente se eliminan los restos acuosos y de la grasa que no llegaron a reaccionar y se deja enfriar y secar, pudiéndose cortar en tacos del tamaño deseado... y ya tenemos jabón artesano, que obviamente cuenta con numerosas variantes.
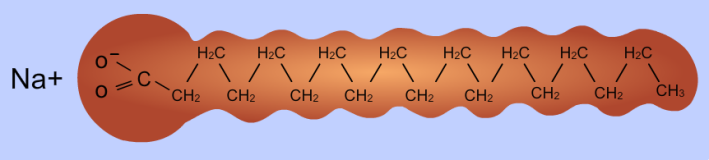
Esquema de una molécula
de jabón, con la “cabeza” afín al agua y la
“cola” afín a la grasa
Ilustración tomada de
https://www.nextgurukul.in
El jabón así obtenido es una mezcla de glicerina y no de los ácidos grasos, sino de las sales sódicas o potásicas que éstos han formado al reaccionar con el álcali. Este detalle es importante, puesto que las sales de los ácidos grasos tienen mucha más afinidad con el agua -es decir, son más solubles en ella- que los propios ácidos grasos, por lo que resultan mucho más útiles que éstos.
Así pues tenemos solucionada la mitad del problema, la del enganche -usando un símil ferroviario- del jabón con el agua. Pero, ¿qué pasa con la otra mitad? De esto se encarga el resto de la molécula del ácido graso -da igual cual sea éste- que, como he comentado, es apolar y, por lo tanto, afín a las sustancias grasas que constituyen las manchas. En consecuencia, nos encontramos con unas moléculas -las sales de los ácidos grasos- que por la cabeza se unen al agua y por la cola a las manchas, con lo cual al lavar la ropa el agua arrastra al jabón y éste a su vez arrastra a las manchas eliminándolas de la ropa... y asunto solucionado.
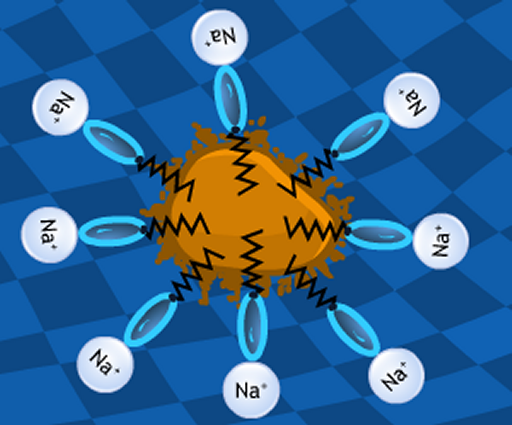
Esquema de como limpia el
jabón, con el agua “tirando” de la sal sódica
(Na+) de las moléculas
de jabón y las
“colas” de éstas (zig-zags negros)
“tirando” de la mancha de grasa
Ilustración tomada
de
https://www.nextgurukul.in
La glicerina, a la que podemos considerar un subproducto del jabón, no sólo no estorba sino que aporta suavidad a éste contribuyendo a contrarrestar su causticidad, así que tampoco viene mal su presencia. Por supuesto los jabones que compramos son sometidos a unos procesos complementarios tales como un refinado y la adición de sustancias como aromas, colorantes, sales minerales, etc., y también depende de la materia prima, es decir, del tipo de grasa empleada, el resultado final. Pero en esencia el proceso es el mismo.
Los detergentes tienen una composición química más compleja y se obtienen por síntesis, es decir, no son naturales, pero la idea es la misma: una molécula cuya cabeza se une al agua mientras la cola lo hace a la suciedad.
Publicado el 9-9-2020
