
La sorprendente versatilidad del carbono
(II) Su
química

Modelo de una molécula de ADN,
uno de los compuestos de carbono más complejos
Si notable es la capacidad del carbono para formar diversos alótropos, es decir, para combinarse con sí mismo, cuando consideramos su capacidad para producir compuestos químicos con otros elementos nos encontramos no sólo con que ésta es única en toda la tabla periódica, sino también con que el número de estos compuestos es no ya elevado, sino mareante.
Por supuesto vamos a ver las razones que explican esta peculiaridad, pero para ello debemos revisar antes algunos conceptos químicos. El carbono, un elemento ligero formado por un núcleo con seis protones y seis neutrones -en su estado isotópico normal- y una corteza electrónica que contiene seis electrones, no tiene en principio una reactividad química exagerada, tal como ocurre con sus “vecinos” oxígeno o flúor; de hecho tanto el diamante como el grafito, sus dos principales modos de presentarse en la naturaleza, son muy inertes. Es por esta razón que su química “normal” -en el sentido de comparable a la del resto de los elementos- resulta más bien pobretona. Tiene dos óxidos, el monóxido de carbono o CO y el dióxido de carbono, o anhídrido carbónico, que responde a la fórmula CO2. Este último forma sales, los carbonatos y bicarbonatos, algunas de las cuales, como la piedra caliza en sus diferentes modalidades (carbonato cálcico, CaCO3), son muy frecuentes en la naturaleza. El primero, por su parte, se combina con algunos metales como el hierro, formando los carbonilos.
Fuera ya de los compuestos oxigenados, el carbono se combina con el hidrógeno formando metano (CH4), con los halógenos formando compuestos como el tetracloruro de carbono (CCl4), con el azufre (CS2), con el silicio (CSi), con el nitrógeno y el hidrógeno formando ácido cianhídrico (CNH), con algunos metales formando carburos, como el carburo cálcico (CCa2)… y poco más, salvo algunos compuestos exóticos preparados en el laboratorio.
Pero el carbono no es un elemento químico “normal”. Su peculiaridad, que le convierte en el más prolífico con diferencia de toda la tabla periódica, es su capacidad para formar cadenas enlazándose consigo mismo, a la par que con otros átomos diferentes, lo que da origen a todo el vasto campo de la química orgánica. En realidad la formación de cadenas, lineales o ramificadas, no se da sólo en el carbono; el silicio también es capaz de hacerlo, y de forma más limitada otros elementos como el azufre, el germanio, el estaño o el boro. Sin embargo, la versatilidad del carbono es muy superior a la de todos ellos, lo que hace de él un caso único.
Puesto que la mayoría de las moléculas formadas por otros elementos químicos suelen ser sencillas y con un número reducido de átomos, es inmediato deducir que la química del carbono será mucho más compleja y numerosa ante la posibilidad de disponer de cadenas de átomos de este elemento enlazados entre sí, máxime teniendo en cuenta que estas cadenas pueden llegar a ser realmente largas y que, además de las cadenas lineales, pueden crearse cadenas ramificadas, ciclos e incluso otras estructuras todavía más intrincadas. No es casualidad, pues, que el carbono no sólo disponga de una química ya de por sí compleja, sino que además haya sido capaz de crear algo tan maravillosamente sutil como es la vida… algo que, independientemente de las especulaciones de los autores de ciencia ficción, no es posible, al menos en las condiciones ambientales en las que nos movemos, para ningún otro elemento químico, ni tan siquiera el silicio.
Por si fuera poco, nos encontramos ante un nivel adicional de complejidad debido a la capacidad del carbono para formar diferentes tipos de enlaces químicos. Puesto que no es éste el lugar adecuado para explicar los diferentes tipos de enlaces químicos presentes en la naturaleza -este tema merece un artículo propio-, intentaré explicar el caso peculiar de nuestro elemento químico sin necesidad de recurrir a conceptos de la mecánica cuántica.
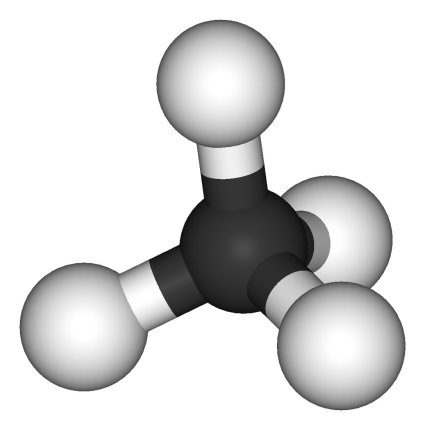
Molécula de
metano, con hibridación sp3
En resumen, puede decirse que el carbono tiene la posibilidad de enlazarse hasta con cuatro átomos distintos -el monóxido de carbono, con un átomo de carbono unido a un único átomo de oxígeno es una excepción-, es decir, dispone de cuatro enlaces disponibles; pero no siempre actúa así. Los cuatro orbitales -que son los que hacen posibles los enlaces- de que dispone el carbono no son idénticos, ya que uno de ellos -el orbital 2s según la terminología química- es diferente de los otros tres orbitales 2p. Sin embargo en la práctica lo que ocurre es que estos orbitales se hibridan, creando unos orbitales híbridos que comparten las características de sus progenitores siendo esta vez todos ellos idénticos. Así, la opción más inmediata es disponer de cuatro orbitales híbridos sp3, terminología que quiere decir que cada uno de estos cuatro orbitales está formado por una cuarta parte del orbital s original y las tres cuartas partes restantes procedentes de los orbitales p.
Estos orbitales tienen una geometría determinada que puede ser calculada gracias a la mecánica cuántica, resultando una estructura tetraédrica. Es decir, podemos imaginarnos al carbono como una bolita de la que surgen cuatro enlaces a modo de barra, todos idénticos y dibujando los vértices de un tetraedro en cuyo centro estaría el átomo de carbono. Ésta es la configuración más habitual del carbono, y es la que determina la geometría de muchos de sus compuestos, desde el diamante -carbono puro cristalizado en una red tetraédrica- hasta el metano, con un átomo de carbono rodeado de cuatro hidrógenos también en forma tetraédrica.
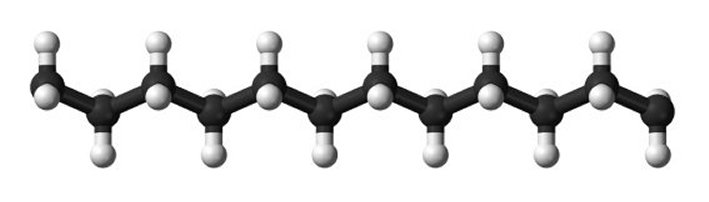
Cadena lineal de
átomos de carbono tetraédricos, con hibridación
sp3
Si en vez de un único átomo de carbono consideramos una cadena de átomos del mismo, nos encontraremos con un esqueleto aproximadamente lineal, pero con los eslabones zizagueando de forma cíclica, ya que el ángulo formado entre los sucesivos átomos de carbono es el que determina la geometría tetraédrica, 109,5º concretamente. Además esta distribución no es plana, sino tridimensional, un factor a tener en cuenta tal como veremos más adelante. Puesto que cada uno de los átomos de carbono de la cadena tendrán ocupados dos de sus cuatro enlaces con los carbonos vecinos -salvo que sean terminales, en cuyo caso sólo ocuparán uno-, le quedarán libres los dos restantes con los que se podrá enlazar con otros átomos o grupos de átomos, bien de carbono bien de elementos químicos distintos.
Pero, tal como apuntaba, no es esta la única posibilidad que tiene el carbono de formar enlaces. Otra opción es que hibride sólo tres de sus cuatro orbitales, concretamente el s y dos de los tres p, formando tres híbridos sp2. Éstos tienen una geometría diferente de los anteriores, ya que forman un triángulo equilátero con ángulos entre sí de 120º. Y son planos, a diferencia de los sp3. Así pues, una molécula o fracción de molécula en la que los átomos de carbono presenten esta hibridación será asimismo plana.
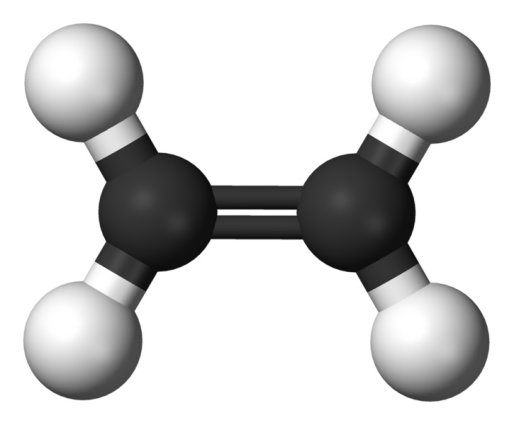
Enlace doble en la
molécula de etileno, con hibridación sp2
¿Qué ocurre con el tercer orbital p, que no había entrado en la hibridación? Se queda tal como está, pero también puede formar un enlace con un átomo vecino, si bien de distinto tipo que los de sus compañeros. Así, mientras los enlaces de los híbridos, tanto sp3 como sp2 son frontales -los químicos los llamamos enlaces σ-, los enlaces de los orbitales p solitarios son laterales, denominándoseles enlaces π. Un punto importante a tener en cuenta es que los enlaces π sólo pueden formarse entre dos átomos vecinos cuando entre ellos ya existe previamente uno σ; es decir, no pueden existir de forma aislada. Por esta razón, al conjunto de los dos enlaces -σ y π- existentes entre dos átomos determinados se le llama enlace doble… aunque en esencia no lo sea, puesto que ambos enlaces sencillos no son equivalentes. Este tipo de enlaces, que se representan gráficamente con una línea doble (=), puede producirse entre dos carbonos o bien entre un carbono y otro átomo que admita también este tipo de hibridación, como ocurre con el oxígeno, el nitrógeno o el azufre.

Enlace triple en la
molécula de acetileno, con hibridación sp
Existe todavía una tercera posibilidad, la del enlace triple (≡). Aquí el mecanismo es similar: tan sólo hibridan el orbital s y uno de los p, produciendo dos híbridos sp que tienen una estructura lineal y también enlazan de forma lineal mediante un enlace σ. Los dos orbitales p restantes actúan como en el caso anterior, formando dos enlaces π laterales situados en planos perpendiculares, pero ambos dirigidos en la misma dirección que la del σ, es decir, entre el átomo central y uno de los dos a los que está enlazado, mientras que con el otro el enlace ha de ser forzosamente sencillo. Otra posible opción es la de los cumulenos, con un carbono con hibridación sp repartiendo sus dos enlaces π entre los dos átomos vecinos formando dos enlaces dobles contiguos -o acumulados- del tipo -C=C=C-, pero se trata de un sistema menos estable energéticamente que la distribución -C-C≡C-.
Como cabe suponer, para que se pueda dar un enlace múltiple, tanto doble como triple, los dos carbonos contiguos han de contar con la hibridación adecuada, la misma para ambos.
Si resumimos todo lo comentado hasta ahora, entenderemos fácilmente la gran versatilidad del carbono para formar infinidad de formas moleculares, sobre todo teniendo en cuenta que tanto los distintos tipos de estructuras -lineales, ramificadas, cíclicas- como los diferentes enlaces -sencillo, doble o triple- se pueden combinar en una misma molécula, lo que da como resultado un número de configuraciones diferentes potencialmente infinitas.
Un caso particular de estructura de especial relevancia es lo que se denomina enlaces dobles conjugados, consistente en una serie de dos o más enlaces dobles alternados con enlaces sencillos del tipo -C=C-C=C- etcétera. Nótese que es un caso diferente al de los enlaces dobles contiguos, o cumulenos, ya que aquí, entre cada dos enlaces dobles siempre aparece uno sencillo. ¿Qué tiene de particular esta configuración? Bien, mucho me temo que tendremos que hacer un pequeño esfuerzo de representación espacial para comprenderlo. Al disponer de un único enlace doble, estos carbonos tienen una hibridación sp2 y, por lo tanto, una estructura de enlaces plana -la de los híbridos sp2- mientras que el enlace π es, como ya he comentado, lateral, discurriendo por encima y por debajo -estos enlaces tienen un doble lóbulo, pero mejor no complicamos más las cosas- del plano que determinan los tres enlaces híbridos, incluyendo claro está su compañero con el que forma el enlace doble. Eso por un lado, pero ¿qué pasa por el otro? Sí, ya sé que también existe un tercero, pero podemos suponer que por allí hay otro tipo de átomo, como por ejemplo un hidrógeno, o bien alguna ramificación -radical, en terminología química-, ya que la cadena de carbonos que estamos estudiando se puede considerar lineal.
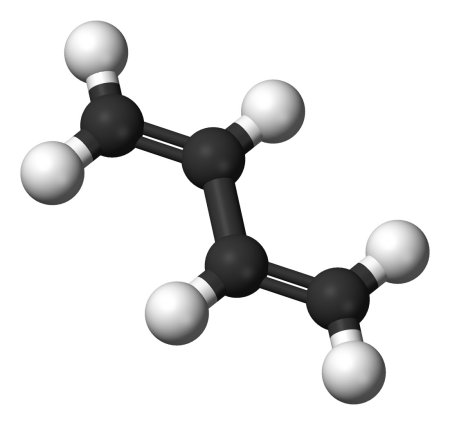
Molécula de
butadieno, con dos enlaces dobles conjugados
Pues por el otro lado habrá otro carbono, también con hibridación sp2, unido al anterior por un enlace sencillo σ, y al siguiente con un nuevo enlace doble combinación de un σ y un π. Volviendo a la fórmula, sería lo ya indicado de -C=C-C=C-. ¿Y qué?, se preguntarán. Bueno, tendrán que disculparme, pero no tengo más remedio que introducir un nuevo concepto, el de resonancia o deslocalización. Recordémoslo, ese grupo formado por un total de cuatro átomos es plano, y los cuatro tienen los dos enlaces π situados de forma paralela, por encima y por debajo de ese plano y además muy próximos, aunque separados por un enlace sencillo. Lo que ocurre, simplemente, es que resuenan, es decir, se acoplan entre sí provocando una deslocalización que los convierte en una especie de enlace -o medioenlace- único que abarca la totalidad del grupo; ya no es como si hubiera, alternadamente, un doble enlace, uno sencillo y otro doble, sino algo así -tómese como un símil, no como una definición precisa- tres enlaces y medios. Y esto es algo que estabiliza enormemente a esta estructura molecular, a diferencia de lo que ocurría con los dobles enlaces contiguos o acumulados del caso anterior.
¿Por qué ocurre esto? Es probable que se pregunten, ya que el sentido común parece indicar que cuanto más próximos estuvieran los dos dobles enlaces más fácil resultaría la conjugación -o resonancia- de ambos. Pues no, y eso se debe a sencillos criterios geométricos. Cuando existen enlaces dobles alternados, la hibridación plana sp2 de los carbonos hace que los orbitales p restantes de todos ellos estén en un mismo plano, perpendicular al del eje del esqueleto de carbonos, por lo que es posible ensamblarlos a todos en un único macroenlace π tal como acabo de comentar. Pero para disponer de dos dobles enlaces contiguos la hibridación del carbono central ya no puede ser sp2 sino sp, lineal en vez de plana, mientras los dos orbitales p restantes se disponen perpendiculares al eje molecular, como en el caso anterior, pero también -y esto creo que no lo había dicho hasta ahora- perpendiculares entre sí. Por lo tanto los dos enlaces π, por muy próximos que puedan estar, presentan entre ellos un giro de 90 grados que hace imposible su acoplamiento. Así pues, juntos pero no revueltos.
¿Puede existir resonancia con enlaces triples? Sí, si se cumple la condición de que estén alternados: -C≡C-C≡C- Pero puesto que los dos enlaces π de cada enlace triple son perpendiculares entre sí, la conjugación será de dos a dos, es decir, cada uno de los enlaces π del primer enlace triple con el correspondiente enlace π del segundo enlace triple que esté en su mismo plano. Es decir, tendremos dos enlaces conjugados, uno por arriba y por abajo y otro a derecha e izquierda. De todos modos, en la práctica se trata de un caso bastante menos importante que el de los dobles enlaces conjugados.

Molécula de
benceno, con conjugación electrónica en todo el anillo
Y ahora llegamos al benceno. Sí, ese hidrocarburo de olor fuerte y penetrante que se usa -o se usaba- como disolvente y ahora está muy restringido a causa de su potencial efecto cancerígeno. ¿Qué tiene de particular? Pues mucho, y para ello debemos volver a nuestro modelo. Como ya he explicado en varias ocasiones, los carbonos con hibridación sp2 dibujan con sus enlaces un ángulo plano de 120º de apertura. ¿Qué pasa si ensamblamos seis de ellos? Pues que nos aparece un hexágono regular. Y como además cada carbono forma un enlace doble con un vecino y uno sencillo con el contrario, resulta que nuestro anillo hexagonal tiene tres dobles enlaces alternados… que se conjugan, resultando a causa de su carácter cíclico una resonancia -o un acoplamiento- mucho más fuerte que la correspondiente a una distribución similar pero lineal. Esto es lo que hace del benceno una de las moléculas más estables de toda la química orgánica, así como un ladrillo fundamental en el ensamblaje de moléculas más complejas a las que por cierto se les llama hidrocarburos -o compuestos, si contienen además algún átomo diferente del carbono y el hidrógeno- aromáticos, pese a que la mayoría de ellos distan mucho de poseer aromas agradables para el olfato.
Porque, había olvidado decirlo, a cada uno de los seis átomos de carbono le queda todavía un enlace libre después de gastar los tres restantes en la estructura del anillo. Estos enlaces, que están también en el plano del anillo pero saliendo hacia afuera de éste, pueden estar ocupados por hidrógenos -éste es precisamente el caso del benceno- o por otros átomos o grupos de átomos, incluyendo claro está a otros carbonos, con lo cual la cantidad de derivados del benceno es realmente inmensa.
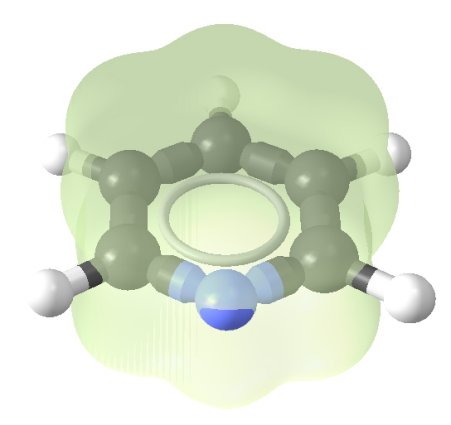
Molécula de piridina, con un átomo de
nitrógeno (azul) sustituyendo a un carbono.
La nube verde representa
a la conjugación electrónica extendida por todo el anillo
Ya puestos a jugar, se nos pueden ocurrir varias alternativas. En primer lugar, ¿qué pasa si sustituimos uno de los carbonos por un átomo diferente? Bueno, eso es posible dependiendo, claro está, del tipo de átomo, porque es necesario que éste pueda adoptar también una hibridación de tipo sp2, algo que no siempre es posible. Si el átomo elegido es el nitrógeno nos encontramos con la piridina, una de las sustancias dicho sea de paso más malolientes con las que he tropezado en mi vida. En la piridina el anillo sigue siendo hexagonal y plano y sigue habiendo resonancia, aunque el nitrógeno, debido a que sólo dispone de tres enlaces, se queda huérfano de hidrógeno. Y por supuesto, sus propiedades químicas varían. También podemos sustituir dos carbonos por nitrógenos, obteniendo en esta ocasión, si los dos nitrógenos son alternos -con un carbono intermedio- el compuesto llamado pirimidina.
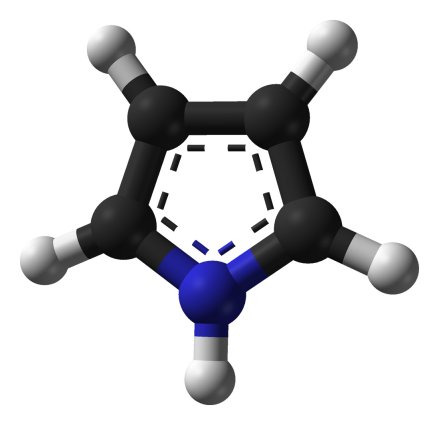
Molécula de
pirrol, con un átomo de nitrógeno (azul) sustituyendo a un
carbono
Aunque existen muchas más posibilidades, desde anillos de seis átomos con un átomo de oxígeno -pirano- o de azufre -tiopirano-, e incluso con dos o más heteroátomos iguales o diferentes, aquí ya no se puede dar una resonancia a lo largo de todo el anillo, por lo que no son ya compuestos bencénicos, o aromáticos, aunque sí existe una resonancia parcial en un arco de éste. También existe una nutrida familia de ciclos de cinco átomos en los que cuatro de ellos son de carbono y el restante nitrógeno -pirrol-, oxígeno -furano-, azufre -tiofeno-, fósforo -fosfol-, silicio -silol-, selenio -selenofeno- o teluro -telurofeno-, pero por la misma razón, pese a presentar conjugación en parte del anillo, carecen de ese plus de estabilidad del que gozan el benceno y sus derivados, debido también a que los anillos de cinco átomos son menos estables que los de seis debido a que los ángulos de un pentágono regular miden 108º, 12 menos que los de un hexágono, por lo cual los enlaces entre los átomos que los forman están asimismo algo forzados.
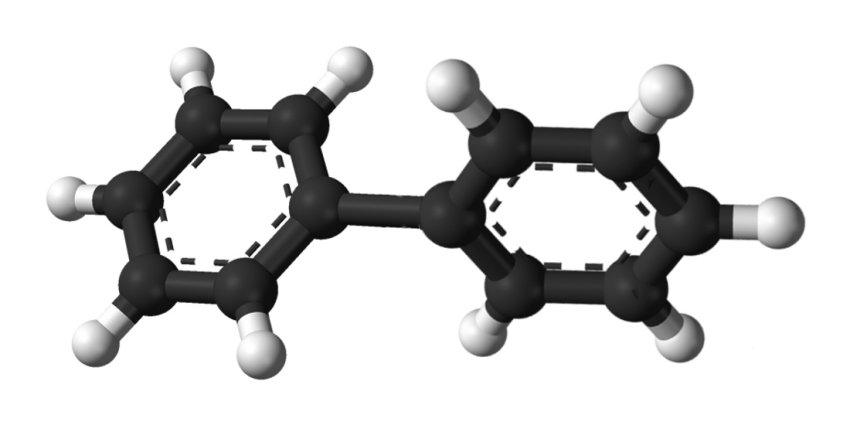 |
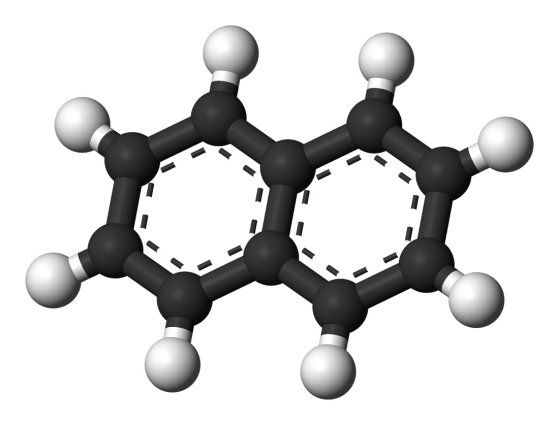 |
|
Moléculas de bifenilo (arriba) y naftaleno (abajo) |
Pero los anillos bencénicos todavía son capaces de dar mucho de sí. También pueden fusionarse, de forma que dos anillos compartan una arista -un enlace- o, si se prefiere, dos vértices -dos átomos de carbono-; estamos hablando del naftaleno, usado tradicionalmente por nuestras madres como un eficaz antipolilla. Conviene distinguir entre este tipo de compuestos y aquellos en los que los anillos se unen aprovechando el enlace libre que les queda a los carbonos, pero sin fusionarse; el bifenilo consiste en dos anillos bencénicos enlazados de esta manera, conservando cada uno de ellos su propia identidad. El naftaleno, por el contrario, tiene los dos anillos fusionados, de manera que no podríamos separarlos sin romper al menos uno de ellos. Otra diferencia entre ellos es que, mientras el bifenilo tiene dos anillos bencénicos completos, es decir, cuenta con doce carbonos, el naftaleno tiene dos carbonos menos, tan sólo diez, debido a que los dos centrales son compartidos por ambos anillos. Puesto que los dos anillos bencénicos del bifenilo son demasiado voluminosos para ocupar el mismo plano, la molécula experimenta una torsión de unos 45º, lo que impide que las resonancias de cada una de sus dos partes se acoplen entre sí. Este problema no existe en el naftaleno, que sí es plano y puede por tanto extender la resonancia a la totalidad de la molécula.
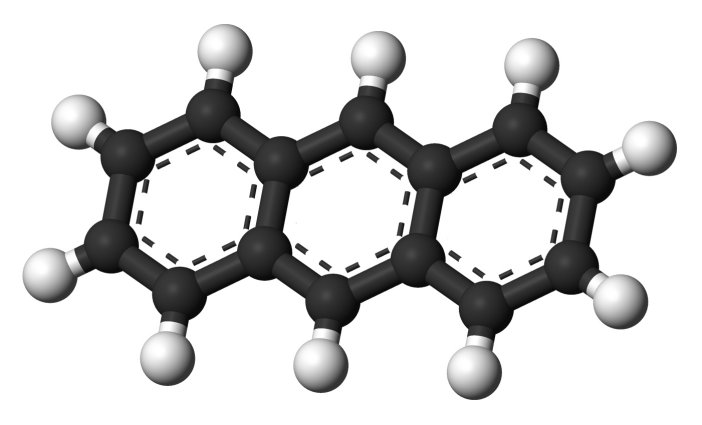 |
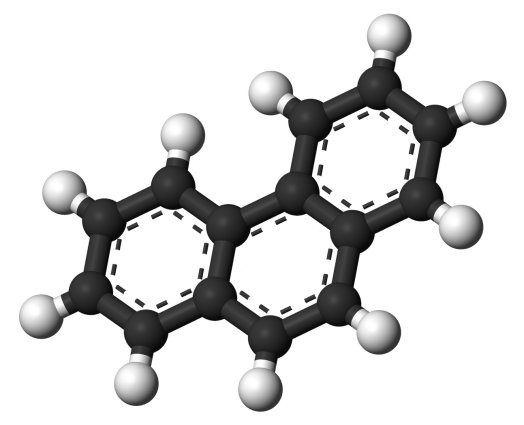 |
|
Moléculas de antraceno (arriba) y fenantreno (abajo) |
Existen, por supuesto, más combinaciones de hidrocarburos aromáticos policíclicos, que es así como se denominan estos compuestos. De ellos los más comunes son el antraceno, con tres anillos bencénicos fusionados en forma lineal y el fenantreno, también con tres anillos pero en esta ocasión dispuestos de forma angular. Otros más complejos tienen curiosas formas geométricas, formando líneas, coronas, triángulos, etc., siempre ensamblando hexágonos como si se tratara de un mosaico. Lo que todos ellos tienen en común, es que la resonancia de los orbitales π se extiende, de una manera más o menos efectiva, por la totalidad de su estructura, afectando de forma decisiva a sus propiedades físicas y químicas.
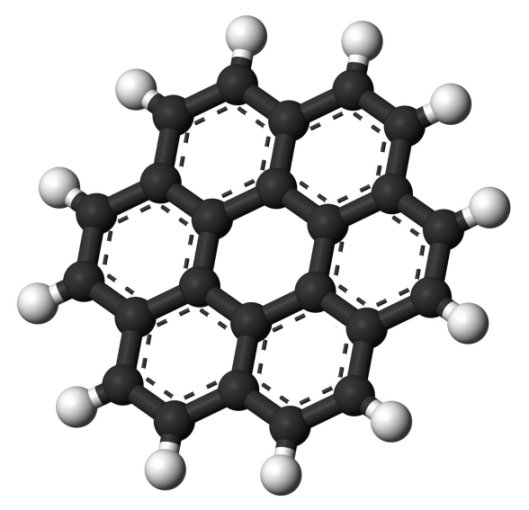
Molécula de coroneno, un hidrocarburo
aromático policíclico de estructura anular
El caso límite de los hidrocarburos aromáticos policíclicos sería un mosaico de anillos bencénicos ensamblados unos con otros en ambas direcciones -recordemos que todas estas moléculas son planas- sin dejar ningún hueco entre ellos, a modo de un panal… esto es precisamente el grafeno, una de las capas que componen el grafito, cuyas propiedades son descritas en el primer artículo dedicado a las propiedades del carbono.
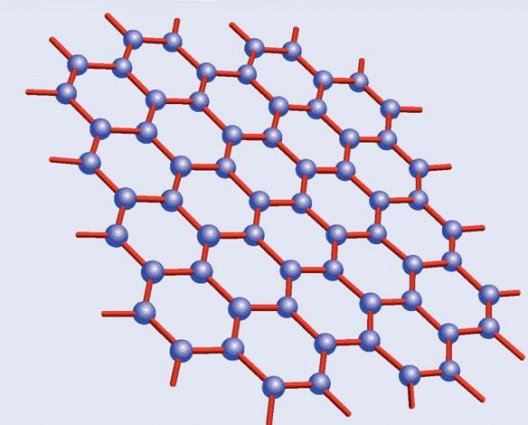
Cristal de grafeno,
con múltiples anillos bencénicos fusionados
Y ya hemos llegado al final… o casi. Tan sólo nos queda recordar que los distintos tipos de moléculas, o estructuras moleculares, que hemos considerado en este artículo pueden a su vez ensamblarse entre sí dando estructuras mucho más complejas, combinándose también con otros átomos como hidrógeno, oxígeno, nitrógeno, azufre, fósforo, flúor, cloro, bromo, yodo… e incluso son capaces de crear sales metálicas.
Como es fácil de comprender, las posibilidades son tan amplias que la química orgánica excede con creces, en número de compuestos, a la de todos los demás elementos químicos juntos. Una de sus ramas, la bioquímica, permite el milagro de la vida, con unos niveles de sutileza en sus procesos químicos que todavía hoy mueven a asombro. Otra rama, la química macromolecular, produce toda una gama de compuestos, los polímeros o plásticos -aunque no todos lo son-, de importancia capital en nuestra vida cotidiana. Y otros muchos compuestos orgánicos están presentes en todas las facetas de nuestra existencia.
Modelo de una molécula
de colesterol
Realmente el carbono da mucho, pero mucho, de sí…
Nota: la mayor parte de las ilustraciones proceden de la Wikipedia.
Ver también: La sorprendente versatilidad del carbono. (I) Sus estados alotrópicos.
Publicado el 15-11-2010
