
Estable, inestable
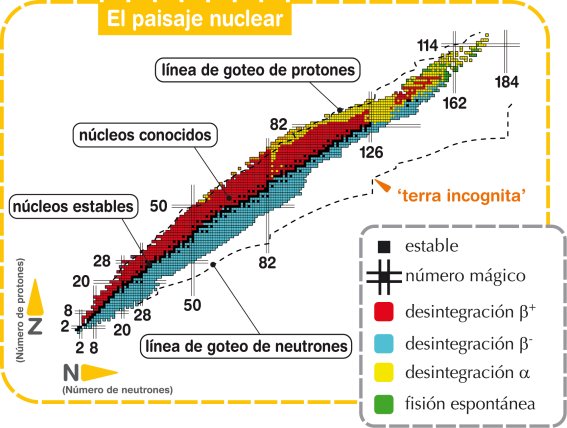
Tabla de los
isótopos conocidos, tanto estables (negro) como inestables
(color)
Ilustración tomada de
Eurisol
A grosso modo, podemos decir que los átomos están formados por un núcleo rodeado de una corteza electrónica. El núcleo, a su vez, consiste en un aglomerado de protones y neutrones, ambas partículas con una masa parecida pero diferenciándose en la carga eléctrica, positiva en los protones e inexistente -de ahí su nombre- en los neutrones.
La misión de los protones es clara, su número -conocido como número atómico- es el que determina el tipo de átomo de que se trata entre los algo más de cien existentes: así, si existe un único protón es hidrógeno, si son seis se trata de carbono, si su número asciende a 26 tenemos hierro...
¿Cuál es el cometido de los neutrones? A diferencia de los protones, éstos ni influyen en el tipo de elemento químico ni, por lo tanto, condicionan las propiedades químicas de los átomos. De una manera aproximada, podría afirmarse que constituyen el “pegamento” que mantiene unidos a los protones en el núcleo, ya que como es sabido las cargas eléctricas del mismo signo -positivo en este caso- tienen tendencia a repelerse. Así pues son importantes, aunque su número no resulte tan relevante a simple vista como el de sus compañeros.
De hecho, los átomos de un elemento químico determinado pueden presentar distinta cantidad de neutrones sin que con ello el átomo pierda su identidad, a diferencia del número de protones que, por definición, ha de ser fijo. Se trata de los isótopos, una palabra que proviene de un término griego que significa “en el mismo lugar” y que define a aquellos átomos que, perteneciendo a un mismo elemento químico, difieren en el número de neutrones que contienen sus respectivos núcleos.
La deducción inmediata que se saca de todo ello nos conduce a dos conclusiones bastante evidentes. Primero, que la cantidad de neutrones no es tan crítica como la de protones, y segundo que, pese a todo, alguna diferencia deberá de haber entre dos o más isótopos de un mismo elemento químico.
Eso es cierto, pero resulta necesario matizarlo. Respecto a lo primero, es preciso añadir que la variabilidad en el número de neutrones se da tan sólo dentro de un reducido intervalo que viene a coincidir, de forma aproximada, con el número de protones para los átomos pequeños y con vez y media el de éste para los átomos pesados. Así, el hidrógeno posee un total de tres isótopos distintos, el hidrógeno propiamente dicho con sólo un protón y ningún neutrón en el núcleo, el deuterio con un protón y un neutrón, y el tritio con un protón y dos neutrones. El carbono, por poner otro ejemplo, cuenta también con otros tres, el carbono 12 (seis protones y seis neutrones), el carbono 13 (seis y siete) y el carbono 14 (seis y ocho). El plomo, un elemento pesado, reúne en su núcleo 82 protones y un número de neutrones que oscila entre los 120 del plomo 202 y los 128 del plomo 210, con un total de ocho isótopos distintos.
Y sí, el número de neutrones crea diferencias entre los isótopos de un mismo elemento. No en las propiedades químicas, que son idénticas, pero sí en las físicas tales como la densidad, el punto de fusión o el punto de ebullición, entre otras; aunque estas diferencias son pequeñas sí son susceptibles de ser medidas y, en su caso, aprovechadas para la separación de los diferentes isótopos, como ocurre con el hidrógeno y el deuterio o con el enriquecimiento del uranio 235 -el que se usa como combustible nuclear- separándolo del uranio 238, mucho más abundante en la naturaleza pero sin utilidad en las centrales nucleares.
Sin embargo, las principales diferencias entre los isótopos son las relativas a sus propiedades nucleares. Como ya expliqué anteriormente, los neutrones ofician de “pegamento” cohesionando los núcleos atómicos, pero esta función sólo es posible cuando se encuentran en la cantidad justa o bien dentro de los estrechos márgenes que comentaba en el párrafo anterior. Tanto un exceso como un defecto de neutrones hacen que el núcleo sea inestable, lo que trae como consecuencia que éste acabe emitiendo radiactividad, bien sea radiación (rayos gamma) o bien partículas subatómicas (rayos alfa y beta), hasta que consigue alcanzar la estabilidad en ocasiones transformándose en un elemento químico distinto.
Antes de seguir adelante es necesario aclarar un concepto: inestable no es equivalente a inexistente en la naturaleza. Esto se debe al hecho de que estos procesos de desintegración radiactiva pueden tener una duración temporal muy diversa, desde un instante hasta millones de años. Por esta razón es posible encontrar en la naturaleza isótopos radiactivos como por ejemplo los de uranio, de muy larga vida, mientras otros sólo se pueden sintetizar en el laboratorio y detectarlos muy a duras penas, tal es su fugacidad.
Gran parte de los elementos químicos conocidos hasta la fecha -112 en este momento- cuentan con algún isótopo radiactivo, y en bastantes de ellos -lo veremos con mayor detalle más adelante- no es posible encontrar isótopos estables. En realidad los isótopos inestables son bastante más abundantes que los estables, 1.200 frente a 300 considerando a la totalidad de los elementos de la tabla periódica, lo que indica que la estabilidad es algo bastante infrecuente que sólo se da cuando la proporción entre protones y neutrones es la adecuada.
Como puede apreciarse en la ilustración, la zona de estabilidad nuclear (puntos negros) dibuja una delgada línea flanqueada por ambos lados por los isótopos radiactivos (puntos de colores), llegando un momento en el que esta línea negra desaparece. Esto ocurre en el bismuto, número atómico 83 y último elemento químico con isótopos estables, ya que a partir del polonio -número atómico 84- hasta el copernicio -número atómico 112- los últimos elementos de la tabla periódica carecen de isótopos estables, aunque algunos de ellos, como el uranio 238 o el torio 232 tienen períodos de vida media del orden de los miles de millones de años. Curiosamente en la secuencia “estable” que va desde el hidrógeno hasta el bismuto existen dos “agujeros” correspondientes al tecnecio -número atómico 43- y al prometio -número atómico 61-, ambos carentes de isótopos estables pese a ser elementos ligeros y encontrarse ubicados en plena región de estabilidad. Existe una complicada explicación teórica al hecho de por qué no existen isótopos estables de estos dos elementos, que a grandes rasgos se puede resumir diciendo que para esos números de protones -43 y 61- no existe ninguna posible combinación de neutrones que pueda estabilizarlos.
Para los elementos más pesados que el uranio, denominados por ello transuránidos, ocurre que, además de ser inestables, las vidas medias de sus respectivos isótopos suelen ser muy breves, a veces del orden de las fracciones de segundo, debido a que su inestabilidad es tal que apenas si pueden llegar a existir antes de transformarse en un isótopo distinto. La tendencia aumenta conforme se incrementa el tamaño de los átomos, de modo que los últimos de la tabla periódica han debido ser identificados mediante sofisticadas técnicas indirectas ya que resulta virtualmente imposible conseguir siquiera unos pocos átomos de los mismos durante el tiempo suficiente para poder someterlos a un análisis detallado. Por poner un ejemplo, la vida media del copernicio, el más pesado de todos los conocidos, alcanza tan sólo los 0,24 milisegundos. Huelga decir que en esas condiciones no es posible encontrar estos elementos en la naturaleza, por lo que todos ellos son artificiales -además de efímeros- generándose por lo común en los reactores nucleares.
De acuerdo con ello, más de uno se preguntará sobre el interés práctico que pueda tener el posible descubrimiento de nuevos elementos superpesados -así es como se les define- fuera del mero prurito académico... pues existe. Según predicen las teorías, existe la convicción entre los físicos nucleares de que, a partir de determinado número de protones, correspondiente a elementos desconocidos por ahora, podría surgir una denominada isla de estabilidad que haría que los isótopos de estos átomos exóticos presentaran una estabilidad mucho mayor que la de sus predecesores, y quien sabe si incluso una estabilidad total tal como ocurre con los elementos más ligeros. Por desgracia sintetizar núcleos tan pesados no es una tarea fácil, y aunque en estos últimos años se ha avanzado bastante en este campo, tan sólo se ha conseguido incrementar en nueve el número de elementos conocidos desde el laurencio -103- descubierto en 1961 hasta el copernicio -112- en 2010, lo que da una idea de la dificultad que presenta.
No obstante, en la actualidad están en fase de desarrollo una nueva generación de instalaciones de haces de iones radiactivos cuya misión es la de sintetizar nuevos núcleos superpesados tales como el proyecto Eurisol -siglas en inglés de Separador de isótopos en línea europeo-, gracias a los cuales se podrán alcanzar avances significativos que permitan completar la tabla periódica, algo por lo que llevan suspirando desde hace muchos años numerosos físicos nucleares.
Publicado el 15-3-2010
