
¿Gadolinio? ¿Y eso qué es?
Equipo de resonancia magnética
nuclear. Fotografía tomada de la
Wikipedia
Hace algún tiempo, y a causa de una de esas revisiones médicas periódicas de las que no nos libramos los que ya pasamos de cierta edad, me hicieron una resonancia magnética nuclear. Yo sabía más o menos de qué se trataba, pero lo que no esperaba era que, previamente a introducirme en el aparato, me inyectaran un contraste de... gadolinio. Y, aunque conocía la existencia de este metal -al fin y al cabo soy químico-, no tenía ni la más remota idea de que se usara para este fin, algo que supongo no le ocurrirá a la mayoría de la gente, que probablemente ni siquiera habrán oído hablar nunca de él.
Pero antes de explicar qué es el gadolinio, conviene saber en qué consisten los contrastes de las pruebas médicas, y por qué se utilizan. Los contrastes, tal como indica su nombre, son unas sustancias que amplifican la resolución de determinadas pruebas médicas permitiendo así un mejor diagnóstico. Como cabe suponer su naturaleza depende de la técnica empleada, adaptándose a los requerimientos de ésta. Veamos varios ejemplos.
Los rayos X, como es sobradamente conocido, permiten estudiar el interior del cuerpo, pero sólo registran información de las partes duras como los huesos, ya que los tejidos blandos son transparentes, o casi transparentes, a esta radiación. Por esta razón, los constrastes utilizados en las radiografías convencionales y en los escáneres, o TAC, que vienen a ser radiografías tridimensionales, son sustancias opacas a los rayos X que permiten contrastar los órganos blandos que se desea estudiar.
Para este tipo de contrastes se suelen utilizar compuestos de elementos químicos pesados, ya que cuanto mayores son los átomos más opacos resultan a los rayos X. Ésta es la razón por la que se usa el plomo como blindaje contra la radiación, pero su uso médico está desaconsejado debido a que sus compuestos suelen ser tóxicos.
Así pues, hubo que buscar otras alternativas. La más antigua, utilizada para radiografías del aparato digestivo, es el sulfato de bario. El bario es un metal pesado que, al igual que el plomo, presenta opacidad a los rayos X, pero cuenta con el inconveniente de que es todavía más tóxico que éste. Pero no se alarmen; el sulfato de bario es una sal insoluble y como tal no puede ser asimilada por el organismo, por lo que, a diferencia de otros compuestos de bario, resulta inocua y tal como entra sale... de forma literal.
Contraste de yodo.
Fotografía tomada de
www.65ymas.com
Aunque el sulfato de bario es muy útil -su sabor desagradable y cierta incomodidad a la hora de eliminarlo no dejan de ser molestias menores- para radiografías de estómago o de otras partes del tracto digestivo, no cubre todas las necesidades de diagnóstico, ya que para otros órganos internos es necesario que el contraste circule por el sistema sanguíneo, lo que implica la necesidad de un compuesto que no sea tóxico en disolución. Para ello se utiliza el yodo, un elemento pesado inocuo para el organismo que incluso se encuentra de forma natural en la tiroxina, una hormona segregada por el tiroides cuya carencia puede provocar trastornos metabólicos serios. Así pues, salvo en el caso de posibles alergias, una sal de yodo disuelta en agua puede ser inyectada directamente en una vena, alcanzando poco después el órgano que se quiere estudiar, que de esta manera se vuelve temporalmente opaco a los rayos X.
Pero ni el bario ni el yodo sirven para la resonancia magnética nuclear, puesto que esta técnica no usa rayos X sino que registra los minúsculos campos magnéticos existentes en el interior del organismo, los cuales, una vez procesados informáticamente, permiten reconstruir una imagen tridimensional del órgano analizado. La RMN presenta dos ventajas sobre las radiografías y los escáneres: es un método inocuo -un exceso de exposición a los rayos X puede causar problemas- y es capaz de registrar imágenes de los tejidos blandos sin necesidad de contraste.
Entonces, ¿en qué quedamos? ¿Hace falta contraste, o no? Pues... en principio no, pero el uso de un contraste facilita el diagnóstico ya que incrementa la resolución y, probablemente, reduce también el tiempo en el que es necesario permanecer dentro del aparato, algo que si ustedes han pasado por esta prueba sin duda considerarán positivo; incluso sin tener problemas de claustrofobia, resulta incómoda por la duración -al menos un cuarto de hora- y la inmovilidad forzada en posturas no siempre cómodas, así como molesta por el elevado nivel de ruido que genera el aparato.
Y ahora sale a relucir el famoso gadolinio. Como cabe suponer, el gadolinio tendrá algo que ver con los campos magnéticos, potenciándolos de forma que resulten más fáciles de detectar. Eso lo supuse de forma inmediata ya que no era una cuestión de química, sino de pura lógica. Pero ¿cómo?
Bien, ahora viene la pequeña lección de química. Como ya he explicado, lo que hace esta técnica es registrar los pequeños campos magnéticos existentes en nuestro organismo, más concretamente los de los núcleos atómicos. El principio teórico es sencillo, aunque su aplicación tecnológica resulta compleja: dos átomos idénticos, si están aislados, presentarán el mismo comportamiento frente a un campo magnético externo; pero si éstos se encuentran en entornos distintos formando parte de moléculas que a su ver pertenecen a células de un órgano determinado, darán respuestas ligeramente diferentes que son las que permitirán reconstruir una imagen virtual del órgano en cuestión.
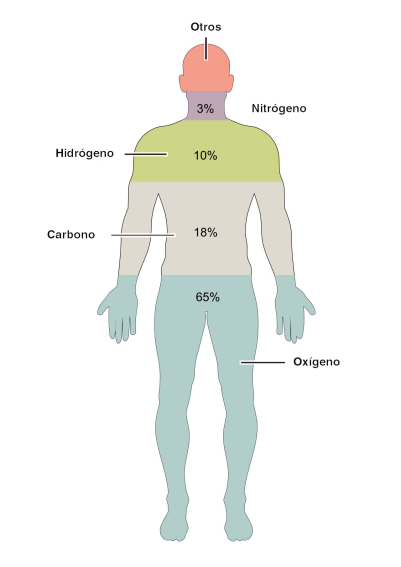
Composición química del cuerpo
humano. Ilustración tomada de la
Wikipedia
En el interior de nuestro cuerpo existen muchos elementos químicos en mayor o menor cantidad. Los principales son el carbono -por supuesto-, el hidrógeno, el oxígeno, el nitrógeno, el calcio y el fósforo, que constituyen casi el 99% de nuestra masa corporal. También son importantes el azufre, el sodio, el potasio, el cloro, el magnesio y el hierro; pero hay muchos más, los denominados oligoelementos, presentes en cantidades muy pequeñas pero no por ello menos necesarios: el yodo, el selenio, el cobalto, el flúor, el manganeso, el cobre, el zinc... así hasta un total de 60, las dos terceras partes de los 94 elementos químicos naturales.
No todos ellos son útiles para la resonancia magnética nuclear, bien porque no interaccionan con los campos magnéticos generados por el equipo, bien porque su presencia es tan escasa que no resulta posible registrarla. Asimismo la susceptibilidad magnética no se produce en un elemento químico determinado, sino tan sólo en aquéllos isótopos del mismo, núcleos con el mismo número de protones, pero con distinta cantidad de neutrones, que presentan un comportamiento magnético diferente al del resto de sus “hermanos”, detalle sobre el que no me voy a extender demasiado para no complicar la explicación.
Así, el carbono “normal”, el isótopo 12C, no presenta susceptibilidad magnética, lo cual es una lástima puesto que constituye el 65% de nuestro cuerpo. Sí la tiene el 13C, pero éste está presente en una ínfima cantidad, poco más del 1% del total de este elemento. Con el nitrógeno ocurre algo similar, y por esta razón el elemento cuyo comportamiento magnético se utiliza suele ser el hidrógeno, que con un 9,5% de nuestra masa corporal tampoco está mal y se encuentra presente en prácticamente todas las células del organismo.
Y a todo esto, ¿qué pinta aquí el gadolinio, que ni siquiera es uno de los sesenta elementos químicos presentes en nuestro cuerpo? Y, para empezar, ¿qué es ese metal de nombre tan raro?
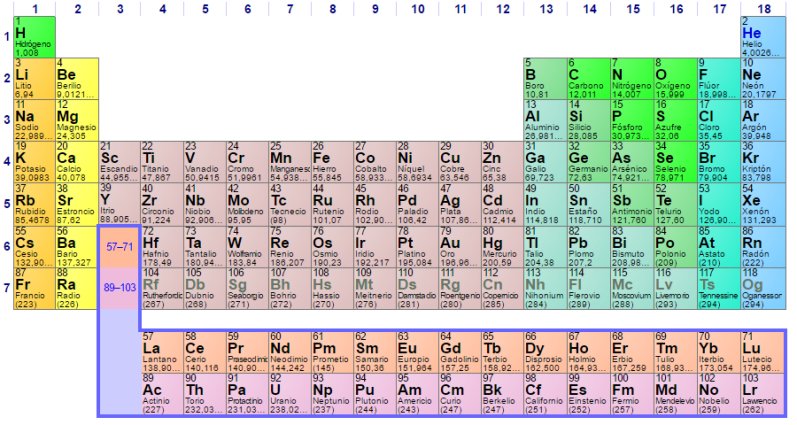
La Tabla
Periódica. El recuadro azul indica el lugar donde irían
colocadas
las dos filas inferiores. Ilustración tomada de la
Wikipedia
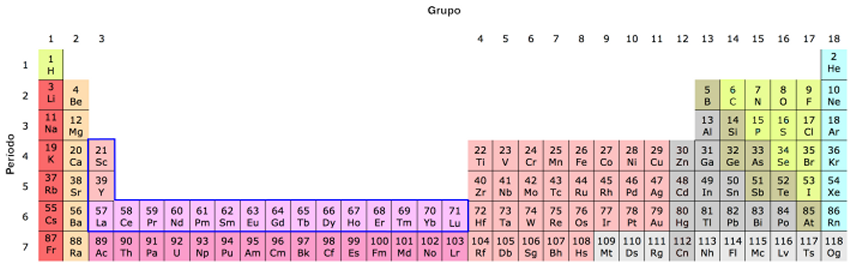
Lo explicaré de forma sencilla. Si se fijan en una tabla periódica, verán que ésta tiene cuatro partes distintas. En los dos extremos aparecen dos bloques, de dos columnas el de la izquierda y de seis el de la derecha, separados por una franja central más ancha -diez columnas- pero más baja, con tan sólo cuatro filas frente a las seis o siete de las laterales.
Bajo el cuerpo que forman estos tres bloques, y separadas de éste, se encuentran otras dos filas de catorce columnas; en realidad deberían estar intercaladas al principio del bloque central, pero por razones de espacio -es la misma razón por la que las islas Canarias aparecen en un recuadrito en los mapas de España- se colocan así, ya que de la otra manera la tabla periódica quedaría demasiado alargada y sería incómoda de manejar.
Fijémonos en la casilla situada justo a la mitad de la fila superior, en la que aparece el símbolo Gd: éste es el famoso gadolinio. Debe su nombre a la gadolinita, un mineral en el que fue identificado en 1880 por el químico Jean Charles Galissard de Marignac aunque no fue aislado hasta 1886 por Paul-Émile Lecoq de Boisbaudran. La gadolinita, a su vez, toma el nombre de su descubridor, el minerólogo finlandés Johan Gadolin.
Los elementos del Sistema Periódico se suelen agrupar en familias, por lo general filas o columnas según el caso, en función de unas propiedades físicas y químicas similares. Una de ellas es la fila en la que se encuentra el gadolinio, catorce metales en total, aunque por motivos prácticos suelen añadírseles los tres pertenecientes a la primera columna del bloque central del Sistema Periódico, el escandio (Sc), el itrio (Y) y el lantano (La), ya que sus propiedades químicas son parecidas a los de éstos aunque en sentido estricto no pertenecen a esta familia.
Como curiosidad, cabe reseñar que en una tabla periódica extendida, en la que las dos filas inferiores estuvieran colocadas en su posición real en lugar de tenerlas segregadas como se hace habitualmente, estos diecisiete elementos dibujarían una letra L tumbada e invertida (└──) con el brazo vertical formado por el grupo del escandio, el itrio y el lantano, y el horizontal por los catorce restantes, siendo la casilla del lantano el vértice de unión entre ambos. Pero lo que nos interesa ahora es el segundo grupo, por lo que nos fijaremos en él olvidándonos de sus tres vecinos.
Tabla
Periódica extendida, con los lantánidos situados en su
ubicación real. El recuadro azul indica
a los lantánidos y al
grupo del escandio, el itrio y el lantano. Ilustración tomada de la
Wikipedia
Los nombres de los catorce metales que lo forman son bastante pintorescos: cerio (Ce), praseodimio (Pr), neodimio (Nd), prometio (Pm), samario (Sm), europio (Eu), gadolinio (Gd), terbio (Tb), disprosio (Dy), holmio (Ho), erbio (Re), tulio (Tm), iterbio (Yb) y lutecio (Lu)... pintorescos y muy poco conocidos por los profanos, mientras para los químicos, al menos cuando yo era estudiante, no dejaban de ser unas curiosidades sobre las que los profesores pasaban prácticamente por encima salvo cuando nos explicaron la estructura del Sistema Periódico.
Conforme a sus peculiaridades atómicas, la denominación oficial de esta familia, que comparte con la fila inmediatamente inferior, es el de elementos de transición interna. No voy a detenerme en la explicación de este nombre, ni en la razón del mismo, ya que remito a quien esté interesado al artículo donde lo explico. Tampoco voy a hablar de los catorce elementos de la fila inferior, puesto que todos ellos son radiactivos y salvo el torio, el uranio y el plutonio -este último de origen artificial-, los once restantes son tan inestables que su vida media es extremadamente corta, por lo que no es posible encontrarlos en la naturaleza.
Centrémonos, pues, en los elementos de la fila superior, más conocidos como lantánidos por ser el lantano el que encabeza el grupo aunque, como ya he explicado, en sentido estricto éste no forma parte de la familia, habiéndose conservado el nombre más bien por razones históricas. Todavía más histórica, y hoy por completo obsoleta, es la denominación de tierras raras con la que fueron conocidos inicialmente, siendo preciso advertir que los químicos del siglo XIX, época en la que fueron descubiertos todos ellos, denominaban tierras a los óxidos metálicos insolubles, en contraposición a las sales que, como el cloruro sódico, tenían aspecto cristalino y se disolvían en agua.
Por su parte, el adjetivo raras no se debía a que fueran realmente escasos en la naturaleza; aunque no sean de los más abundantes, su presencia es similar en cantidad a la de metales tan familiares como el cromo, el níquel, el cobre, el zinc, el estaño, el wolframio o el plomo, y aun los más escasos de ellos son mucho más frecuentes que el oro. Pero a diferencia de los anteriores, los lantánidos no se encuentran formando yacimientos fáciles de explotar, sino dispersos en diversos minerales en unas concentraciones muy bajas que dificultan y encarecen su extracción.
 |
 |
|
Gadolinita (izquierda) y monacita (derecha),
dos de las pricipales menas de los lantánidos |
|
A ello hay que sumar una dificultad añadida que trajo de cabeza a varias generaciones de químicos a lo largo del siglo XIX e incluso parte del XX: sus propiedades químicas y físicas son tan parecidas que, con los medios de la época, resultaba extremadamente difícil separarlos de sus compañeros. Por si fuera poco hasta fechas recientes apenas tenían aplicaciones prácticas y su demanda era mínima, lo que explica que les colgaran el sambenito de raros no en el sentido de escasos, sino en el de difíciles de encontrar e identificar y todavía más de obtener en estado puro, una condición indispensable para poder estudiar sus propiedades.
Claro está que en la actualidad la situación ha cambiado por completo y hoy es posible obtenerlos en estado puro de forma relativamente sencilla, aunque son muy pocos sus yacimientos y la mayoría se encuentran en China, lo que supone un problema económico y político dada su condición de materiales estratégicos. De hecho todos los lantánidos, incluyendo el escandio, el itrio y el lantano, tienen utilidad en numerosas aplicaciones tecnológicas, e incluso unos objetos tan comunes como los teléfonos móviles no serían posibles sin ellos. Bueno, en realidad existe una excepción, el prometio, que por ser radiactivo y muy inestable no se encuentra en la naturaleza y sólo se puede obtener de forma artificial en pequeñas cantidades, lo que no impide que se le hayan encontrado algunas aplicaciones como isótopo radiactivo.
El gadolinio, por su parte, se utiliza en algunas aleaciones especiales y también para la fabricación de láseres, tubos de rayos X o informática. Hasta aquí en poco se diferencia de sus compañeros, pero tal como comenté, es el único de todos ellos al que se le ha encontrado una utilidad médica.

Gadolinio metálico. Fotografía tomada de la
Wikipedia
Dice el refrán que algo tendrá el agua cuando la bendicen, por lo que algo tiene que haber en el gadolinio que le distinga de los demás en el caso concreto de su uso como contraste en la resonancia magnética nuclear, máxime cuando, vuelvo a repetirlo, las propiedades químicas y físicas de todos los lantánidos son muy similares.
La explicación viene dada por la peculiar configuración de su corteza electrónica, y para entenderla tendremos que manejar algunos conceptos básicos de la mecánica cuántica que sirven para explicar la estructura de los átomos. Ah, para empezar les recomiendo que se olviden por completo de la teoría atómica de Bohr que estudiaron en el colegio, ésa que imaginaba a los átomos como sistemas solares en miniatura en los que el núcleo oficiaba de sol y los electrones describían órbitas en torno suyo a modo de planetas. Como primera aproximación no estuvo mal, pero pronto se comprobó que no era cierta y hoy su interés es meramente histórico, al mismo nivel que la teoría geocéntrica de Ptolomeo o las ideas evolutivas de Lamarck.
Aunque para la mecánica cuántica los núcleos siguen siendo similares a los de la teoría de Bohr, en forma de aglomerados de neutrones y protones, la distribución de los electrones en torno suyo es totalmente distinta. De hecho ya no se habla de órbitas sino de orbitales, y les recomiendo que la similitud entre ambos nombres no les mueva a confusión ya que es puramente histórica y los orbitales no tienen nada que ver con las órbitas en el sentido en que las entendemos.

Distintos tipos de orbitales
atómicos. Fotografía tomada de la
Wikipedia
Según la mecánica cuántica, los orbitales son unas regiones tridimensionales en las que se sitúan los electrones, pero hay que considerarlos no como una trayectoria cerrada sino como el territorio que ocupa cada uno de ellos. En consecuencia, y éste es el concepto fundamental, lo que interesa no es saber dónde está situado un electrón en un momento concreto, tal como los astrónomos calculan las coordenadas de un planeta o un satélite, sino la zona espacial en torno al núcleo donde existe la probabilidad de encontrarlo. Dicho con otras palabras, para la mecánica cuántica el electrón no es una bolita que se mueve en torno al núcleo, sino que lo considera como si estuviera disperso por todo su territorio, es decir, por el volumen del orbital.
Sí, ya sé que este concepto no resulta nada intuitivo, pero el hecho es que funciona y ha permitido entender la estructura electrónica de la totalidad de los átomos conocidos.
Si lo han entendido, podemos pasar al siguiente punto. Los orbitales se distribuyen de forma concéntrica en torno al núcleo de forma similar a las capas de una cebolla, aunque no todos ellos son esféricos y, dependiendo del tipo los hay de varias clases distintas-, adoptan formas geométricas diversas; pero para lo que nos interesa aquí no es necesario profundizar en este tema.
Como es sabido, cada elemento químico se caracteriza por tener un número determinado de protones que se corresponden con otros tantos electrones, de forma que su carga eléctrica total es nula porque las de unos y otros se compensan. Los protones se encuentran en el núcleo acompañados por los neutrones, los cuales no intervienen en estas cuestiones -aunque sí en otras-, por lo que los vamos a ignorar. Por su parte los electrones se sitúan en los orbitales, tal como he explicado.
Y ahora un último esfuerzo. La cantidad y la forma de los orbitales vienen determinados por una serie de parámetros, denominados números cuánticos, sobre los que tampoco me voy a extender. Lo que sí es importante tener en cuenta es que, aunque estos cuatro números cuánticos dependen de los protones que tiene un átomo determinado, su cantidad crece más deprisa que la de los protones y, por consiguiente, que la de los electrones. Además, en cada orbital puede haber hasta dos electrones.
En consecuencia, en la mayoría de los átomos existen más orbitales o, por decirlo con mayor precisión, más espacios disponibles que electrones, por lo que una parte de ellos quedarán vacíos, o semivacíos si están ocupados por un único electrón. Así pues, nos podemos encontrar con tres alternativas diferentes: un orbital vacío, un orbital ocupado por un único electrón y un orbital completo con dos electrones.
¿Qué tiene que ver esto con los campos magnéticos que genera la RMN? Pues mucho. A efectos magnéticos, y por razones obvias, un orbital vacío no afecta a su núcleo. Cuando un orbital está ocupado con dos electrones la situación es similar, ya que aunque todos los electrones están cargados negativamente, su comportamiento magnético se contrarresta produciendo una resultante nula.
La situación es diferente en los orbitales que contienen un único electrón, ya que al no estar contrarrestado por ningún otro, se produce lo que los físicos denominan efecto paramagnético, que consiste en una influencia de éste sobre el campo magnético del núcleo, que resulta ligeramente afectado. Y si en vez de uno son varios los electrones desapareados -así es como se denominan los electrones solitarios en un orbital-, sus efectos se suman.
Es justo aquí donde reside la singularidad del gadolinio no ya dentro de los lantánidos, sino en la totalidad del Sistema Periódico: de los 118 elementos químicos conocidos es el que más electrones desapareados tiene, siete en total. Prefiero no entrar en detalles sobre las razones que conducen a este resultado porque complicaría demasiado la explicación, pero la razón es ésta.
Por lo tanto, el gadolinio es el elemento químico más adecuado ya que el efecto paramagnético de estos siete electrones sobre el núcleo es máximo, lo que a su vez conduce a una intensificación de la respuesta de los átomos vecinos -los hidrógenos presentes en las células- a los campos magnéticos generados por el aparato de RMN. Así de sencillo... ¿o no?
Contraste de gadolinio. Fotografía tomada de la
Wikipedia
Queda todavía un último detalle. El gadolinio es tóxico, pero aquí no es posible recurrir a una sal insoluble, como ocurría con el bario, ya que se aplica por vía intravenosa. La solución que se encontró fue la de introducirlo en un quelato, que es una molécula compleja en cuyo interior queda retenido el metal como si fuera en una jaula, lo que evita el contacto directo que provocaría su toxicidad. Puesto que el efecto del gadolinio no es químico, sino magnético, la capa aislante que lo envuelve no interfiere en éste, obteniéndose el resultado deseado al tiempo que se evita su toxicidad, puesto que el organismo lo elimina en unas pocas horas tal como ocurre con el sulfato de bario, aunque en este caso por la orina.
Cierto es que, como cualquier otra sustancia de aplicación médica, cuenta con algunas contraindicaciones, y asimismo hay algunas investigaciones que alertan sobre la posibilidad de que pudiera provocar alteraciones renales incluso en personas a las que no les afectan estas contraindicaciones. En cualquier caso, y asumiendo que los médicos lo utilicen con la necesaria cautela, yo siempre recuerdo una frase que solía decir un profesor mío de química: todo es veneno, hasta el jamón; todo depende de la dosis.
Publicado el 27-4-2020
