
La sutileza de la isomería
Etimológicamente, isomería significa “de partes iguales”, y se aplica a los compuestos químicos que, pese a tener una misma composición, presentan propiedades físicas o químicas diferentes.
La explicación es sencilla. Como es sabido, un compuesto químico es un conjunto de átomos o iones dispuestos formando moléculas o cristales; la diferencia entre estos últimos es que, mientras las moléculas cuentan con un número finito y normalmente fijo de átomos, los cristales son simplemente una distribución, normalmente tridimensional, de los mismos, sin ningún límite a su cantidad aunque sí a su proporción. Por esta razón, el concepto de isomería suele ser aplicado tan sólo a las moléculas, o bien a sistemas como los cristales moleculares que las contienen en su interior.
Una molécula, pues, es un conjunto finito de átomos, del mismo o de distintos elementos químicos, agrupados de una forma que les es propia. Salvo en el caso de las macromoléculas, o compuestos poliméricos, en los que intervienen otros factores, una molécula se caracteriza por poseer un número determinado de átomos, siempre el mismo y, en el caso de haber de varias clases diferentes, cada uno de ellos en la misma cantidad. También es característica de la molécula la forma en la que se distribuyen estos átomos, siendo este último factor el que determina el concepto de la isomería.
En resumen, se habla de isomería cuando nos encontramos con dos compuestos químicos -o dos moléculas, por hablar con mayor propiedad- que, pese a tener la misma composición química -idénticos átomos, en idéntica cantidad y proporción-, presentan estructuras distintas. Es decir, tienen los átomos distribuidos de distinta manera.
En la práctica para que exista isomería la molécula necesita poseer cierta complejidad, de modo que haya al menos dos maneras posibles de “ensamblarla”. Por esta razón no suele darse en los compuestos inorgánicos sencillos ya que, por poner un ejemplo, si nos fijamos en el ácido sulfúrico tan sólo hay una forma de distribuir, de acuerdo con la forma en que cada átomo se enlaza con los vecinos, el átomo de azufre, los cuatro de oxígeno y los dos de hidrógeno que constituyen su molécula. Por esta razón, el ácido sulfúrico no puede presentar isomería de ningún tipo. Esto no quiere decir que la isomería no sea posible en las moléculas inorgánicas, simplemente ocurre que éstas suelen ser, por lo general, demasiado sencillas para presentarla. La situación cambia en las moléculas más complejas, siendo en general las orgánicas las que suelen presentar isomería debido al mayor número de posibles combinaciones del que son capaces los átomos de carbono.
Isomería estructural
La isomería más sencilla que se puede dar es la denominada isomería estructural, que depende de la colocación de los átomos en la molécula.
Por ejemplo, dos compuestos tan sencillos como el alcohol etílico y la acetona son isómeros estructurales, ya que ambos presentan la misma composición química C2H6O -es decir, cuentan en su molécula con dos átomos de carbono, seis de hidrógeno y uno de oxígeno- pero ambos están distribuidos de diferente manera, concretamente:
| H | H | |||||||
| | | | | |||||||
| H | — | C | — | C | — | O | — | H |
| | | | | |||||||
| H | H |
Para el alcohol, y
| H | H | |||||||
| | | | | |||||||
| H | — | C | — | O | — | C | — | H |
| | | | | |||||||
| H | H |
Para la acetona.
Obsérvese que sólo con el cambio de posición del átomo de oxígeno, que pasa de estar unido a un carbono y a un hidrógeno, a estarlo a los dos carbonos, las propiedades físicas y químicas de ambos compuestos cambian. A este tipo particular de isomería estructural se le denomina isomería funcional, dado que los grupos funcionales -una agrupación de átomos dentro de una molécula con propiedades químicas propias, como el grupo alcohol (O-H) o el grupo cetona (C-O-C)- cambian al reagruparse los átomos.
En ocasiones los grupos funcionales se mantienen, pero se sitúan en diferentes puntos de la molécula. Es lo que ocurre con el alcohol propílico, que sin dejar de ser alcohol, es decir, manteniendo el grupo O-H, puede presentar estas dos configuraciones:
1-propanol
| H | H | H | ||||||||
| | | | | | | ||||||||
| H | — | C | — | C | — | C | — | O | — | H |
| | | | | | | ||||||||
| H | H | H |
2-propanol
| H | H | H | ||||||
| | | | | | | ||||||
| H | — | C | — | C | — | C | — | H |
| | | | | | | ||||||
| H | O | H | ||||||
| | | ||||||||
| H |
Según se sitúe en un carbono terminal -posición 1- o en el carbono central -posición 2-. Obviamente, cuanto más larga sea la molécula más posibilidades de cambio hay. En este caso se habla de isomería de posición, por razones obvias.
El tercer tipo de isomería estructural es la denominada isomería de cadena, o de esqueleto, y depende de la forma en la que se encadenan los átomos de carbono que constituyen el esqueleto de la molécula. Puesto que cada carbono tiene la posibilidad de enlazarse hasta con otros cuatro átomos -de carbono o de otros elementos químicos-, es evidente que, para un mismo número de átomos, podremos tener cadenas lineales, ramificadas, enlazadas, cíclicas...
Isomería geométrica o cis-trans
Este tipo de isomería supone un salto en complejidad frente a la anterior, y para explicarla debemos recordar previamente una de las propiedades del carbono -y también de otros átomos- como es la posibilidad de formar enlaces dobles. Tal como he comentado anteriormente, el carbono puede enlazarse hasta con otros cuatro átomos, aunque la preposición “hasta” indica que no es obligatorio que lo haga con todos ellos... porque también se da la posibilidad de que establezca con alguno de estos átomos lo que los químicos denominamos un enlace múltiple, tanto doble (C = C) como triple (C ≡ C).
Para el tema de la isomería cis-trans nos quedaremos con el enlace doble. Ocurre que, a diferencia de los enlaces sencillos, en los cuales los átomos que los forman pueden rotar alrededor de su eje, los enlaces dobles son rígidos. Veamos un ejemplo, primero con un enlace sencillo, donde F es un átomo de flúor:
| F | F | |||||
| | | | | |||||
| H | — | C | — | C | — | H |
| | | | | |||||
| H | H |
Esta molécula es exactamente la misma que ésta:
| F | H | |||||
| | | | | |||||
| H | — | C | — | C | — | H |
| | | | | |||||
| H | F |
Ya que el enlace entre los dos carbonos puede rotar, cambiando la posición relativa del átomo de flúor sin que se altere la estructura real de la molécula, que sigue siendo la misma en ambos casos.
Sin embargo no ocurre lo mismo con los dobles enlaces, ya que éstos son rígidos y no permiten la rotación; se puede entender intuitivamente si los consideramos como dos barras paralelas ensambladas a sendas bolas por sus respectivos extremos. En este caso ya tenemos dos compuestos distintos, según sea el isómero cis:
| F | F | |||||
| | | | | |||||
| H | — | C | = | C | — | H |
| | | | | |||||
| H | H |
O bien el isómero trans:
| F | H | |||||
| | | | | |||||
| H | — | C | = | C | — | H |
| | | | | |||||
| H | F |
Los términos cis y trans provienen del latín y quieren decir, respectivamente, del mismo lado y del lado opuesto.
 |
 |
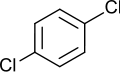 |
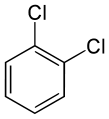
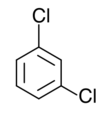
Los tres isómeros cis-trans del dicloro benceno
También pueden presentar este tipo de isomería los compuestos que forman anillos planos, como por ejemplo el benceno, aunque aquí el número de posibles isómeros se incrementa en función de la complejidad del anillo. Para el benceno, que es el más sencillo de todos -un anillo hexagonal de átomos de carbono, cada uno de ellos unido a un hidrógeno-, tenemos hasta tres posibles isómeros cuando dos de los hidrógenos son sustituidos por otros átomos o grupos moleculares, según sean estos contiguos, alternados con un hidrógeno entre ambos o bien estén situados en vértices opuestos. El número de alternativas, obviamente, se incrementa cuando son más de dos sustituyentes, o bien con ciclos más complejos.
Isomería óptica o enantiomería

Louis Pasteur, descubridor de
la isomería óptica
Dando un paso más en la sutileza de los distintos tipos de isomería, nos encontramos con la isomería óptica o enantiomería. El primero de los nombres procede del fenómeno, descubierto en el siglo XIX, de que los compuestos con isomería óptica desvían la luz polarizada hacia un lado o hacia el contrario dependiendo de que se trate de uno o de otro isómero; en cuanto a la enantiomería, procede de un término griego que vendría a significar algo así como “el opuesto”.
Para explicar este tipo de isomería tenemos que introducir el concepto tridimensional de la simetría, ya que aquí no estamos hablando de isomería en un plano, como era el caso anterior, sino en el espacio; y como siempre, recurriremos al ejemplo tradicional de las dos manos. Las manos son simétricas, ya que una es la imagen especular -el reflejo en el espejo- de la otra, pero no son superponibles. Por esta razón no podemos recurrir a un esquema molecular plano, como en los casos anteriores, sino a representaciones tridimensionales siempre más complicadas de ver. Es decir, debemos hablar de “a derechas” y “a izquierdas”.
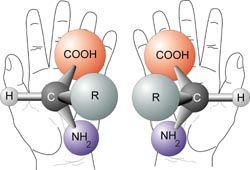
Simetría
especular de los isómeros ópticos
Ilustración
procedente de la NASA
La isomería óptica se produce cuando un átomo de carbono está unido a cuatro átomos, o grupos de átomos, todos ellos diferentes; hay que tener en cuenta que la estructura de este grupo molecular no es plana, sino en forma de tetraedro con el carbono en el centro. A estos átomos se les llama quirales, término procedente también del griego cuyo significado es “mano”.
Volvamos a recurrir a un símil: si tomamos un tetraedro de madera, pongo por caso, y le pintamos los cuatro vértices con cuatro colores diferentes, uno para cada vértice, independientemente del orden en que lo hagamos siempre tendremos, girando el tetraedro, tan sólo dos alternativas -o isómeros- posibles, “a izquierdas” y “a derechas”. Estas dos variantes no son intercambiables, igual que la mano derecha no es intercambiable con la izquierda, y se diferencian en que, colocando los dos tetraedros de manera que los colores de dos de los vértices coincidan en ambos, los otros dos restantes estarían cambiados entre sí.
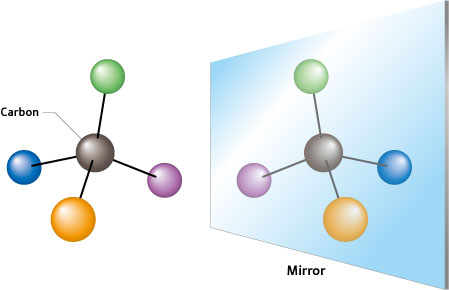
Carbono
tetraédrico quiral
Los dos isómeros ópticos tienen en principio las mismas propiedades químicas, haciendo la salvedad de que esto es sólo cierto cuando reaccionan con compuestos que no presentan este tipo de isomería. Por el contrario, cuando hacemos reaccionar un compuesto que presenta isomería óptica -uno de los dos isómeros, evidentemente- con un segundo compuesto que tenga asimismo esta propiedad, sí existe una especificidad en el proceso, debido a que para que algunos tipos de reacciones químicas tengan lugar es necesario que los átomos estén colocados de la manera correcta y no al revés, al igual que no podemos ponernos un zapato del pie contrario... bueno, poder sí podríamos, pero resultaría bastante incómodo.
Si la complejidad de la molécula lo permite, puede ser que en ella tengamos no uno, sino varios carbonos quirales. En este caso lo que ocurre es que no hay dos, sino más isómeros ópticos, concretamente 2n siendo n el número de carbonos quirales -también llamados asimétricos- de la molécula. Así, si nos fijamos en el caso de la glucosa, vemos que cinco de los seis carbonos de su molécula son asimétricos, con lo cual el número de posibles isómeros será de 25, es decir, 32. Obviamente estos isómeros sólo son imágenes especulares entre ellos dos a dos, ya que sería como si tuviéramos una serie alternada de manos izquierdas y derechas de modo que, por ejemplo, d-d-i-d-i sólo es imagen especular de i-i-d-i-d, pero no de i-d-d-d-i. En este caso no se trata de enantiómeros sino de diastereoisómeros, ya que la especularidad sólo se produce, como mucho, en parte de la molécula, pero no en su totalidad.
Si bien en la química orgánica “normal” la estereoisomería no pasa de ser una curiosidad científica, su importancia en los procesos bioquímicos es fundamental, ya que muchas de las substancias que intervienen en los procesos metabólicos de los seres vivos, como los hidratos de carbono o las proteínas, no sólo presentan esta propiedad, sino que asimismo son estereoselectivos, es decir, reaccionan sólo con determinados isómeros ópticos y no con sus posibles alternativas. Así pues todos estos productos de origen natural, como por ejemplo los aminoácidos que forman las proteínas, presentan únicamente un tipo de isomería óptica, y sólo ellos pueden ser procesados por nuestras enzimas. Si sintetizáramos en el laboratorio una proteína artificial de diferente isomería óptica, no podríamos digerirla pese a ser químicamente idéntica a “las de verdad”.
Tacticidad
A la tacticidad, término que en griego significa “orden”, se le puede considerar como un caso particular de la isomería óptica aplicable a las moléculas poliméricas, o macromoléculas. En realidad se trata de la extrapolación del concepto de la diastereoisomería -es decir, la existencia de varios carbonos asimétricos o quirales en una molécula- a las cadenas moleculares extremadamente largas de los polímeros, donde ya no tenemos un número discreto de carbonos quirales como era el caso de la glucosa, sino muchos, del orden de decenas o centenares de miles para cada molécula, distribuidos según una secuencia que puede ser regular o no.
Tomemos el caso de un polímero conocido, como por ejemplo el policloruro de vinilo o PVC. En él nos encontramos con cadenas lineales -y muy largas- de carbonos en los cuales, de forma alterna, los carbonos digamos “pares” están unidos a dos átomos de hidrógeno además de a los dos átomos de carbono contiguos -no son, pues, asimétricos-, mientras los carbonos “impares” lo están a un átomo de hidrógeno y a otro de cloro, por lo que sí presentan quiralidad. Es decir, tenemos una secuencia de tipo carbono simétrico-carbono asimétrico. Huelga decir que en el caso particular de las macromoléculas basta con que los dos átomos o grupos moleculares que están unidos al carbono en cuestión sean diferentes entre sí, ya que sus otros dos sustituyentes -las dos ramas de la cadena- siempre lo son por definición.
Y como es natural, la forma en que estén colocados los átomos unidos a los carbonos quirales influirá en la tacticidad. En esencia, tenemos dos posibles situaciones límite, bien con todos ellos colocados “al mismo lado”, lo que se denomina isotacticidad:
| Cl | H | Cl | H | Cl | H | Cl | H | |||||||||||
| | | | | | | | | | | | | | | | | |||||||||||
| R | — | C | — | C | — | C | — | C | — | C | — | C | — | C | — | C | — | R’ |
| | | | | | | | | | | | | | | | | |||||||||||
| H | H | H | H | H | H | H | H |
Bien la sindiotacticidad, si la disposición es alternada:
| Cl | H | H | H | Cl | H | H | H | |||||||||||
| | | | | | | | | | | | | | | | | |||||||||||
| R | — | C | — | C | — | C | — | C | — | C | — | C | — | C | — | C | — | R’ |
| | | | | | | | | | | | | | | | | |||||||||||
| H | H | Cl | H | H | H | Cl | H |
Siendo R y R’ los dos extremos de la cadena molecular, por los cuales seguiría la misma cadencia.
 |
 |
|
Modelos de polímeros isotáctico (arriba) y sindiotáctico (abajo) |
Obviamente existe una tercera posibilidad, intermedia entre ambas, la de que la distribución sea al azar. En este caso, se habla de atacticidad.
Claro está que aquí hemos considerado que los monómeros que formaban la cadena polimérica -los “eslabones”- estuvieran colocados siempre en la misma disposición, la denominada “cabeza-cola”, razón por la que los carbonos enlazados al cloro están siempre alternados con los carbonos que están unidos a dos hidrógenos. Huelga decir que existe la posibilidad -y éste sería ya un tipo distinto de isomería- de que las uniones sean tipo “cabeza-cabeza” o “cola-cola” siguiendo determinadas pautas o asimismo al azar, lo que determinará que los carbonos clorados estén en algunas regiones contiguos o bien separados por dos carbonos sin cloro... en este polímero, que es uno de los de estructura más sencilla, ya que en otros más complejos la variabilidad podría ser, como cabe esperar, mucho mayor.
Y eso es todo...
Publicado el 18-3-2010
