
La Tabla Periódica de los elementos químicos
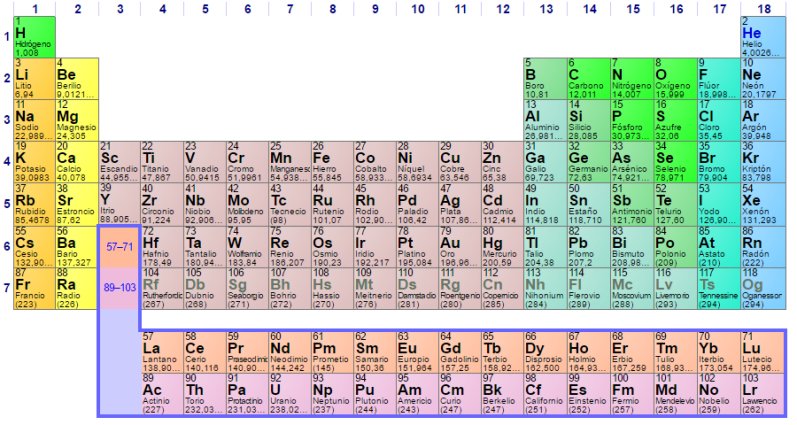
La Tabla
Periódica de los elementos químicos en diciembre de
2016
Ilustración tomada de la
Wikipedia
Como es sabido, la Tabla Periódica es una clasificación en forma de cuadro bidimensional -filas y columnas- en la que se representa a la totalidad de los elementos químicos conocidos -118 por el momento- ordenados en función de sus propiedades químicas. Aunque ahora nos parezca evidente, esta clasificación no lo fue en modo alguno para los químicos hasta que Dimitri Mendeleiev no la dio a conocer en fecha tan relativamente tardía como 1869.
En realidad la Tabla Periódica de Mendeleiev no era exactamente la que ahora conocemos y manejamos, ya que agrupaba en una misma columna a todos los elementos que formaban compuestos de estequiometría -la proporción numérica entre los diferentes átomos que forman una molécula o un compuesto químico- similar con el oxígeno y el hidrógeno, mientras que en las tablas modernas todas estas columnas están desdobladas para diferenciar entre los elementos que, aun teniendo una misma estequiometría, pertenecen en realidad a dos familias distintas. No obstante, en ella ya estaban establecidos los principios básicos que, han permanecido inalterables hasta hoy en día, razón por la que se le considera el creador de la misma, aunque conviene no olvidar que el químico alemán Julius Lothar Meyer llegó a conclusiones similares de forma prácticamente simultánea.
Tabla Periódica de Mendeleiev.
Apréciese que es mucho más compacta que la
actual
Ilustración tomada de la
Wikipedia
Como suele ocurrir a menudo, una vez realizado un descubrimiento importante se constata que los mecanismos que lo regulan acostumbran a ser sorprendentemente sencillos. Así, Mendeleiev se guió básicamente por dos criterios: dispuso los elementos químicos conocidos en su época en orden creciente de masas atómicas, es decir, de más pequeños a más grandes, y cuando apreciaba que las propiedades químicas volvían a repetirse saltaba a la siguiente fila empezándola por la primera columna, es decir, de izquierda a derecha y de arriba a abajo tal como se escribe un texto saltando a la siguiente línea al llegar al final de la anterior.
Claro está que Mendeleiev tuvo la suficiente intuición como para saltarse los huecos de los elementos químicos desconocidos en su época, argumentando con acierto que éstos acabarían siendo descubiertos más adelante. Asimismo solventó de una manera un tanto audaz el hecho de que la ordenación real de los elementos químicos no ha de hacerse en función de la masa atómica sino del número atómico, es decir, el número de protones existentes en el núcleo del átomo, ya que los neutrones que los acompañan, y que conjuntamente con éstos determinan la masa atómica, no intervienen en las propiedades químicas que caracterizan a cada uno de los elementos químicos existentes en la naturaleza. El concepto de número atómico no se había establecido todavía en tiempos de Mendeleiev (el protón fue descubierto en 1919, y el neutrón en 1932), así que el químico ruso utilizó el único criterio de clasificación del que podía disponer, la ya citada masa atómica. Aunque ambas magnitudes, número y masa atómica, suelen crecer de forma simultánea, hay algunas excepciones, por lo que lógicamente éstas no encajaban. ¿Qué hizo Mendeleiev? Invertir su orden, por lo cual siguió, sin saberlo, el criterio correcto.
La Tabla Periódica de Mendeleiev, además de ser un monumento al raciocinio humano, fue una construcción completamente empírica, ya que ni él ni nadie de su época podían conocer los mecanismos que regulaban su estructura. La comprensión de los mismos no llegaría hasta muchos años después, cuando la mecánica cuántica permitió estudiar la sistemática que la gobierna.

Dimitri Mendeleiev a finales
del siglo XIX
Fotografía tomada de la
Wikipedia
Pero antes de seguir debemos considerar, siquiera de forma breve, la estructura de los átomos. Como es sabido, éstos cuentan con un núcleo formado por un número determinado de protones y neutrones rodeado por una nube electrónica; el modelo está simplificado -en realidad es más complejo-, pero nos sirve para nuestros fines. Lo que determina las propiedades de un átomo haciendo que éste sea de aluminio y no de potasio, o de nitrógeno, es el número de protones existentes en su núcleo. Los neutrones no afectan a las propiedades químicas -aunque sí a otras-, razón por la que en este estudio podemos prescindir de ellos.
En realidad los que determinan las propiedades químicas, o la naturaleza, de un átomo no son en sentido estricto los protones, sino los electrones; pero ocurre que en los átomos el número de ambos es siempre el mismo -de forma que se compensan las cargas eléctricas respectivas-, por lo cual el razonamiento anterior sigue siendo válido.
Así, podemos imaginarnos construyendo los átomos de la Tabla Periódica empezando por el más sencillo, el hidrógeno, que cuenta tan sólo con un protón en el núcleo y un electrón en la corteza. Si a este protón le añadimos otro -y el número de electrones aumenta a dos- ya no tendremos hidrógeno, sino helio; con tres protones y tres electrones tendremos litio, con cuatro berilio, con cinco boro, con seis carbono... así hasta llegar al último de los descubiertos por ahora, que responde al poco romántico nombre provisional -todavía no ha sido bautizado de forma definitiva- de ununoctio, con ciento dieciocho protones y otros tantos electrones.
Tal como he comentado los responsables de las propiedades químicas de los átomos son los electrones, pero no influye sólo su número sino también su distribución, algo que hasta la Mecánica Cuántica no hemos podido establecer. Y antes de seguir adelante les pido una cosa: olvídense para siempre del falso modelo que nos presenta a los átomos a modo de sistemas solares en miniatura, con una bolita grande central -el átomo- y otras más pequeñas -los electrones- describiendo órbitas en torno suyo. Este modelo, postulado por Rutherford y Bohr a principios del siglo XX, fue tan sólo una primera aproximación a la realidad que, aunque acertando en lo fundamental -la distribución de las partículas subatómicas en un núcleo central y una corteza exterior-, no acertaba a explicar las sutilezas de modelo real. Su interés es histórico, pero ningún científico lo maneja ya desde que se disponen de modelos más adecuados.
Aunque sí es cierto que los electrones se encuentran rodeando al núcleo, en realidad éstos no son “bolitas”, sino más bien unas distribuciones de carga eléctrica -una descripción detallada de los mismos excede los propósitos de este artículo- repartidas por unas regiones del espacio denominadas orbitales. Entiéndase que un orbital, pese a la similitud de los nombres, no es en modo alguno una órbita, sino un volumen de determinada forma y tamaño por el que se encuentra “disperso” -no es así, pero mejor no profundizamos- el electrón. Y son precisamente estos orbitales, convenientemente ocupados por sus respectivos electrones los que determinarán en definitiva las propiedades químicas del átomo en cuestión.
Confío en que no se hayan perdido, porque a partir de ahora hay que introducir un concepto no demasiado intuitivo, el de los números cuánticos. ¿Qué son los números cuánticos? Pues una serie de reglas matemáticas sencillas -cuatro en total- que determinan, para un átomo en concreto, el número de orbitales que van a estar ocupados por sus electrones. O, dicho de otra manera, si seguimos la secuencia creciente de la Tabla Periódica, nos dirán como y cuando los electrones van a ir ocupando sus respectivos orbitales al pasar de un átomo al siguiente. Es decir, nos van a determinar la estructura interna de la Tabla Periódica, algo que Mendeleiev sólo pudo establecer por intuición.
Una última advertencia: si bien un orbital puede estar ocupado o vacío no ocurre lo contrario, ya que un electrón siempre tiene que estar en un orbital. Y no en cualquiera, sino en el que le corresponda según la secuencia marcada por los cuatro números cuánticos.
Y un símil que quizá pueda ayudar a comprender la estructura interna de la corteza electrónica. Imagínense que se trata de una cebolla formada por varias capas, con la salvedad de que estas capas no son homogéneas, sino que cuanto más al exterior estén más gruesas son y más subdivididas en subcapas están.
Y ahora vayamos al grano. Los cuatro números cuánticos han sido bautizados -existe una razón, pero de nuevo nos saldríamos del tema para explicarla- con las letras n, l, m y s -la “y” no es un número cuántico, sino una simple conjunción-, llamándose también, respectivamente, número cuántico principal -el n-, número cuántico angular -el l-, número cuántico magnético -el m- y número cuántico de espín, o giro -el s-.
Volviendo al símil de la cebolla, podríamos definir de la siguiente manera la función de los cuatro números cuánticos: el principal determina la capa; el angular en cuantas subcapas se divide ésta; el magnético cuantos orbitales hay en cada subcapa, y el de espín indica que en cada orbital se pueden acoplar hasta dos electrones, eso sí cada uno “girando” en un sentido, y pongo “girando” entre comillas ya que se trata de un concepto cuántico de difícil explicación en base a conceptos comunes, pero que viene a decir que ambos comparten el orbital estando juntos, pero no revueltos. En definitiva esto es consecuencia del Principio de Exclusión de Pauli, uno de los pilares de la Mecánica Cuántica, que postula que dos electrones de un mismo átomo no pueden tener los cuatro números cuánticos iguales, lo que viene a querer decir en lenguaje corriente que dos electrones no pueden estar en el mismo sitio... algo por lo demás bastante evidente.
¿Preparados? Pues vamos allá, y espero saberme explicar. Los cuatro números cuánticos van encadenados, lo que quiere decir que dando un valor determinado al primero los demás van adquiriendo los que les corresponden en base a las reglas que expongo a continuación: para cada valor de n -se me olvidaba decir que excepto s son siempre números enteros- l adopta los valores comprendidos entre 0 y el valor de n - 1. Es decir, para n = 1 -el valor más bajo posible- l sólo puede valer 0, ya que 1 - 1 = 0. Para n = 2, l tiene dos posibles valores, 0 y 1. Para n = 3, tenemos tres valores de l, concretamente 0, 1 y 2. Y así sucesivamente.
¿Queda claro? Pues sigamos adelante. Para cada valor de l, independientemente del n a que corresponda, m adopta los valores comprendidos entre - l y + l contando siempre de uno en uno. Por ejemplo, para l = 0 m sólo puede valer 0; para l = 1 tenemos tres valores de m, -1, 0 y 1. Para l = 2 son cinco los valores de m, -2, -1, 0, 1 y 2. Como puede comprobarse van incrementándose siempre de dos en dos.
Sólo nos falta el número cuántico s, pero no se asusten, es el más fácil de todos; sólo tiene dos valores posibles, - ½ y + ½, y es aplicable a cualquier combinación de los tres anteriores. Y ya hemos terminado, ¿a que no ha sido tan complicado? En resumen, podemos definir a cualquier electrón de un átomo sin más que dando los valores correspondientes a sus cuatro números cuánticos, es algo parecido a una matrícula o, todavía mejor, a una dirección postal. Si decimos que un electrón tiene como números cuánticos n = 2, l = 1, m = 0 y s = +½, pongamos por ejemplo, eso quiere decir que está en la segunda capa -a partir de ahora lo llamaremos período, por razones que explicaré más adelante-, en la segunda subcapa o tipo de orbital -recordemos que l empieza en 0 y no en 1 como el anterior- y en el segundo orbital de ese tipo del total de los tres existentes. Por último, s indica que es uno de los dos posibles electrones que caben en ese orbital.
¿A que no es tan complicado? Pues vamos hasta el final, que ya está cerca. Acabo de decir que el valor de l indica el tipo de orbital que tenemos; ¿por qué no bautizarlos? De nuevo, con cierta falta de imaginación, estos tipos de orbitales se denominaron con diferentes letras, una para cada valor de l. Así, para l = 0 tenemos orbitales de tipo s, que no hay que confundir con el número cuántico de espín. Para l = 1 son orbitales p, para l = 2 orbitales d, para l = 3 orbitales f, y a partir de aquí se sigue el orden alfabético: g, h, i...

Representación de los orbitales s, p y d de los
tres primeros períodos
Ilustración tomada de la
Wikipedia
Estas denominaciones proceden de la espectroscopía, dicho sea a modo de anécdota, pero no necesitamos saber su significado exacto. Baste con saber, ya a modo de resumen, que el primer período, es decir, la capa electrónica más cercana al átomo, tiene un único orbital s, ya que para n = 1, l = 0 y m = 0, por lo que caben en él tan sólo dos electrones.
Para la segunda capa, o segundo período, la cosa cambia. Aquí tenemos un orbital s (l = 0) y tres orbitales p (l = 1), cada uno con un valor de m distinto entre - 1 y + 1. En total esto hace cuatro orbitales, con capacidad para ocho electrones.
En el tercer período la cosa se complica. Además del orbital s y los tres orbitales p -como puede comprobarse cada período repite todo lo del anterior y además añade orbitales nuevos- tendremos ahora cinco -desde m = -2 hasta m = + 2- orbitales d. En total son 9 orbitales y 18 electrones. Y así sucesivamente.
Y ya hemos terminado, o casi. Fíjense, esto es importante, en que hasta el momento no hemos estado hablando de electrones, sino de orbitales; es decir, de la capacidad máxima de ocupación de la corteza electrónica en función de los números cuánticos. Que estos orbitales se llenen o se queden parcialmente vacíos dependerá del átomo en cuestión, y eso es precisamente lo que nos toca ver ahora.
¿Se atreven? Pues adelante. Dejémonos ahora de consideraciones abstractas y vayamos al grano, es decir, a los átomos, comenzando lógicamente por el más sencillo, es decir, el hidrógeno.
El hidrógeno tiene tan sólo un protón y su correspondiente electrón, que habrá que ver donde colocamos; y para eso están precisamente las reglas que hemos estado considerando. Como cabe suponer tendremos que empezar por los valores más bajos de los números cuánticos, es decir, con n = 1, que como acabamos de ver indica que sólo tenemos un único orbital de tipo s con capacidad para dos electrones... y ahí es donde se coloca el que tenemos, dejando vacío el otro hueco. Puesto en la terminología adecuada diríamos que la configuración electrónica del hidrógeno es 1s1, lo que significa que tenemos un único electrón -el 1 del superíndice- en el orbital s del primer período.
Pasemos ahora al helio, que es el siguiente elemento químico. El helio tiene dos electrones, el primero de los cuales se coloca justo donde estaba el del hidrógeno mientras el segundo lo que hace es completar el hueco que quedaba vacante en el orbital s. dicho con otras palabras, su configuración es 1s2. Volviendo un momento atrás recuerdo que ambos electrones comparten el mismo orbital, diferenciándose por los siguientes valores del número cuántico de espín. ¿Cuál de los dos vale -½ y cuál vale +½? Tanto nos da, puesto que son indistinguibles. Lo único que sabemos es que no pueden estar el uno en el mismo sitio que el otro, pero en el orbital hay hueco para los dos y sólo para los dos.
Y se nos acabó el primer período, es decir, la primera capa electrónica, ya que sus números cuánticos no dan para más. ¿Qué ocurre, pues, cuando añadimos el tercer electrón, cosa que ocurre con el litio? Pues que saltamos automáticamente al segundo período, es decir, al correspondiente a n = 2. Llegados aquí ya puedo explicar algo que hasta ahora tan sólo había apuntado: un período es una fila horizontal de la Tabla Periódica, que a su vez corresponde a una capa electrónica con un valor de n determinado.
Tal como hemos visto anteriormente, para el segundo período tenemos un total de cuatro orbitales, uno s -como antes- y tres p, con una capacidad para ocho electrones. El litio, pues, lo que hace es “estrenar” capa -o período, como se prefiera-, y por esta razón aparece en la Tabla Periódica en la columna de la izquierda justo debajo del hidrógeno. Por cierto, se me había olvidado advertirles sobre la conveniencia de que vayan cotejando mis explicaciones con una Tabla Periódica, por eso de que una imagen vale más que mil palabras. El electrón del litio tiene en principio ocho opciones para elegir, así que ¿dónde se coloca? Vaya ahora una nueva regla: los orbitales s se llenan siempre antes que los p de su correspondiente período. Así pues, la configuración electrónica del litio es 1s2 2s1, lo que quiere decir que sus dos primeros electrones los coloca en el orbital s del primer período -como el helio- mientras el electrón restante se sitúa en el orbital s del segundo período.
El elemento químico que sigue al litio, ya con cuatro electrones, es el berilio. ¿Adivinan ustedes dónde se colocará el nuevo electrón? No es tan difícil, completa el orbital s que su compañero había empezado. Así pues, su configuración electrónica es 1s2 2s2. En cuanto a su ubicación en la Tabla Periódica será, lógicamente, a la derecha del litio.
Por cierto, si ustedes son perspicaces se harán una pregunta: ¿por qué el berilio no está debajo del helio, como parecería lógico, sino que este último se encuentra a la derecha del todo? La respuesta es sencilla, pero habrá que esperar todavía un poco para explicarla. Por favor, tengan un poco de paciencia.
A diferencia del primer período, aquí con el berilio no hemos acabado, ya que todavía seguimos teniendo los tres orbitales p disponibles. Así pues, el quinto elemento de la Tabla Periódica, el boro, lo que hace es colocar su nuevo electrón en el primero de los orbitales p, con la configuración electrónica 1s2 2s2 p1. Y los cinco restantes, lógicamente, van completando los orbitales p, cada uno con un electrón más: carbono, nitrógeno, oxígeno, flúor y neón. Con el neón, que tiene como configuración electrónica 1s2 2s2 p6, ocurre lo mismo que pasaba con el helio, completamos capa y cerramos el período; por esa razón el helio aparece encima del neón y no encima del berilio, ya que una configuración electrónica completa en la última capa confiere unas propiedades químicas similares independientemente de que estos electrones ocupen orbitales s u orbitales p. ¿Aclarada la duda?
A tenor de lo ya dicho, supongo que a nadie le extrañará que en el tercer período se repita una secuencia similar a la del período anterior: la configuración electrónica del sodio (de símbolo químico Na) es, en su última capa -normalmente no se indican las anteriores para evitar tener que escribir tanto- 3s1, la del magnesio 3s2, la del aluminio 3s2 p1, la del silicio 3s2 p2, y así sucesivamente el fósforo (símbolo P), el azufre (S), el cloro y el argón, que cierra la capa con la configuración ya conocida de 3s2 p6.
¿Que cierra período? ¿No habíamos dicho que en este tercer período teníamos, además del orbital s y los tres orbitales p, cinco flamantes orbitales d todavía sin estrenar? ¿Qué pasa con ellos? No, no estamos haciendo trampa. Ocurre que, aunque pertenecientes a la última capa electrónica, es decir, la más exterior de toda la corteza, estos orbitales d son los más interiores de este período, ya que olvidé decir que el orden de llenado de los orbitales de un mismo período es de siempre fuera hacia dentro, siendo los s los más externos y los “nuevos” los más internos. Así pues, cuando le llega el turno al potasio (símbolo K) el nuevo electrón se encuentra con dos opciones, la de ocupar el primero de los cinco orbitales d del tercer período, o bien saltar al orbital s de un nuevo período, el cuarto... y opta por esto último, al serle más fácil acceder al orbital 4s -su configuración electrónica es 4s1- que hacerlo a uno cualquiera de los 3d. Insisto de nuevo, hay formulaciones teóricas rigurosas que demuestran lo que ocurre en la naturaleza, pero sería demasiado complicado explicarlas aquí.
Tras el potasio le llega el turno al calcio, cuya configuración electrónica no tiene nada de particular ya que el nuevo electrón se limita a completar el orbital 4s, con una configuración 4s2.
Las cosas cambian con el siguiente elemento químico, el escandio, de símbolo Sc. Aquí el electrón vuelve a tener dos posibles opciones, colocarse en un orbital 4p o acordarse de los orbitales 3d que habían quedado vacíos... y se decide por lo segundo, ya que si bien a los dos elementos anteriores no les “compensaba” colocar su electrón en esos orbitales frente al orbital 4s, no ocurre lo mismo con los 4p. Dicho con otras palabras, el llenado de los orbitales 3d se intercala entre el 4s y los 4p. Por esta razón el escandio tiene como configuración electrónica 4s2 3d1, lo que hace que en la Tabla Periódica no se coloque debajo del aluminio sino iniciando una columna nueva que se intercala entre la del berilio y la del boro.
Y no sólo el escandio. Si nos fijamos en la Tabla Periódica, veremos que la región central en la que se sitúa abarca un total de diez elementos, desde el escandio hasta el cinc (Zn), justo los diez electrones que caben en los cinco orbitales 3d. Obviamente de izquierda a derecha se va incrementando el número de electrones de uno en uno, hasta llegar al cinc en el cual la configuración es 4s2 3d10. Basta con contar el número de orden para saber cuantos electrones d tiene cada uno de estos diez elementos; así, el hierro (Fe) tendrá seis puesto que es el sexto, el níquel ocho o el cobre (Cu) nueve.
Tras el cinc viene el galio, que vuelve a comportarse de una manera “normal” ya que coloca su electrón en uno de los tres orbitales 4p, lo que hace que su configuración electrónica sea 4s2 3d10 4p1; por esta razón se le coloca debajo del aluminio. Sigue luego la secuencia con los otros cinco elementos que completan los orbitales 4p, desde el germanio hasta el kripton -nada que ver con la kriptonita de Superman, por supuesto- que, al igual que ocurría con el argón, cierra el período... claro está que siguen quedando vacíos no sólo los orbitales 4d tal como ocurría en el período anterior, sino también los nuevos orbitales 4f, siete en total con capacidad para catorce electrones.
Se inicia el quinto período igual que lo hiciera el cuarto, en esta ocasión con el rubidio (Rb) que tiene una configuración 5s1. Sigue el estroncio (Sr) con 5s2 y, al igual que ocurriera en el cuarto período, a continuación se llenan los cinco orbitales 4d con los diez elementos que van desde el itrio (Y) al cadmio (Cd), es decir desde la configuración 5s2 4d1 a la 5s2 4d10. Tras ellos vuelven los seis elementos químicos que ocupan los orbitales 5d, desde el indio -5s2 4d10 5p1- hasta el xenon -5s2 4d10 5p6-, con lo que queda concluido el quinto período.
¡Un momento! Ya sabíamos que los orbitales d se ocupan con un período de retraso, por lo que es normal que los 5d se queden vacíos; ya se llenarán, siguiendo la secuencia conocida, durante el sexto período. Pero, ¿qué pasa con los orbitales 4f? Pues lo mismo que con los d, pero todavía más acentuado; no se llenan con un período de retraso, sino con dos. Así pues, no les llegará el turno hasta el sexto período. Por supuesto lo mismo ocurrirá con los 5f, vacíos hasta el séptimo período. ¿Y con los 5g que aparecen ahora, nueve flamantes orbitales con capacidad para dieciocho electrones? Pues... es de suponer que ahí estarán, y que se llenarían con al menos dos -y probablemente más- períodos de retraso, pero... llegará un momento en el que se nos acaben los elementos químicos conocidos -ya lo veremos más adelante-, y da la casualidad de que eso ocurre antes de que tocara ocuparlos. Así pues, no merece la pena que nos preocupemos por ellos, ya que en la práctica es como si no existieran.
Comenzamos el sexto período igual que siempre, con el cesio (Cs) y el bario ocupando el orbital 6s, y luego... en la Tabla Periódica pasa algo raro, ya que nos encontramos con una casilla vacía que remite a una larga fila de quince elementos situada debajo, desde el lantano hasta el lutecio, todos con nombres de lo más exótico como praseodimio, neodimio, gadolinio o disprosio. ¿Qué es lo que ocurre ahora?
Bueno, tranquilícense, no es nada extraño ni nos hemos salido de la Tabla Periódica, simplemente había que hacer otro corte para incluir a los catorce elementos que ocupan los orbitales f y, de hacerlo “dentro” de la Tabla Periódica nos habría salido ésta tan larga que no nos cabría ni siquiera en formato panorámico. Así pues, y simplemente por razones de comodidad, ese trozo se ha cortado y se ha puesto abajo, en definitiva es lo mismo que ocurre en los mapas de España con las islas Canarias, que se ponen en un cuadradito en la esquina para que quepan.
Sí, a tenor de lo dicho es fácil adivinar lo que ocurre; estos catorce elementos están llenando los siete orbitales 4f con dos períodos de retraso, tal como ya he explicado, después de que lo hiciera el orbital 6s y justo antes de los 5d. Pero... hemos contado quince, y no catorce, así que nos sobra uno...
No, no sobra. Ocurre que, a estos niveles de “profundidad” los orbitales electrónicos están muy cercanos unos a otros, por lo cual los electrones se encuentran frente a opciones muy parecidas. Así, aunque el lantano en realidad ocupa un orbital d exactamente igual que lo hiciera el itrio -técnicamente es 6s2 5d1-, el cerio que es el que le sigue prefiere empezar el melón de los orbitales f, adoptando la configuración 6s2 5d1 4f1. A partir del cerio el resto de los elementos siguen su misma pauta, conservando los dos electrones 6s y el único electrón 5d, con el número de electrones 4f que corresponda a cada uno. Es un poco lioso, lo reconozco, pero las cosas son así en la naturaleza.
Con el lutecio llegamos a la configuración 6s2 5d1 4f14, que completa el llenado de los orbitales 4f, razón por la que el hafnio (Hf) coloca su nuevo electrón en los orbitales 5d cayendo debajo del titanio y el circonio (Zr). Desde el hafnio hasta el mercurio (Hg) se completan los orbitales 5d, de forma que este último tiene la configuración 6s2 5d10 4f14. A continuación del mercurio el talio vuelve a la “normalidad” con los orbitales 6p -6s2 5d10 4f14 6p1-, y se completa período con el radón -6s2 5d1 4f14 6p6-.

Nicolás Copérnico, en cuyo homenaje fue
bautizado al elemento número 112 con su nombre
Ilustración
tomada de la
Wikipedia
Aunque el séptimo, y por ahora último, período está todavía muy poco estudiado debido a que todos sus componentes son inestables y, por lo tanto, extremadamente difíciles de investigar, su pauta es exactamente la misma que la del período anterior. Comienza con el francio y el radio llenando el orbital 7s, sigue con el actinio que, al igual que el lantano, coloca su electrón en el orbital 6d; continúa desde el torio (Th) hasta el laurencio (Lr) llenando los siete orbitales 5f, y finaliza el “rellenado” de los orbitales internos retomando los 6d restantes desde el rutherfodio (Rf) hasta el recién descubierto copernicio (Cn), que hace el número 112.
¿Qué pasa después? Pues que, como cabía esperar, a continuación les llega el turno a los orbitales 7p, que ocupan las casillas correspondientes a las familias comprendidas entre la del boro y la de los gases nobles. Son seis elementos en total, desde el 113 hasta el 118, todos ellos muy poco conocidos todavía a causa de lo reciente de su descubrimiento y lo dificultoso de su estudio: el nihonio (Nh, de número atómico 113), el flerovio (Fl, 114), el moscovio (Mc, 115), el livermorio (Lv, 116), el téneso (Ts, 117) y el oganesón (Og, 118), que es el que por el momento cierra la tabla.
Y se acabó... por ahora, claro está, porque cabe esperar que en los próximos años se descubran nuevos elementos químicos. Es de suponer que éstos sigan también las pautas de los anteriores, encajando sin problemas en la Tabla Periódica; aunque eso ya se verá.
Queda pendiente, eso sí, hablar de una de las características más importantes de la Tabla Periódica, la predicción de las propiedades químicas de los elementos en función de su posición en la misma; pero esto es ya tema para otro artículo.
Publicado el 12-3-2010
Actualizado el
2-12-2016
